Install the app
How to install the app on iOS
Follow along with the video below to see how to install our site as a web app on your home screen.
Se debe tener en cuenta: This feature may not be available in some browsers.
Estás usando un navegador obsoleto. No se pueden mostrar este u otros sitios web correctamente.
Se debe actualizar o usar un navegador alternativo.
Se debe actualizar o usar un navegador alternativo.
Crionica, inmortalidad y transhumanismo
- Autor Pereirano
- Fecha de inicio
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459
Capitulos 9 y 10 del libro "El futuro va mas rapido de lo que crees" de Peter H. Diamandis y Steven Kotler
Capítulo nueve
El futuro de la atención médica
Martine y los sueños imposibles
Era la clase de noticia que nadie quiere recibir.
En 1992, la hija de Martine Rothblatt descubrió que le quedaban menos de cinco años de vida. 1 Los médicos hablaban de hipertensión pulmonar, una enfermedad respiratoria muy rara que, en tiempos recientes, sólo ha afectado a dos mil estadounidenses. No obstante, resulta muy sencillo malinterpretar la modestia de esta cifra: la enfermedad no tiene piedad de nadie, y se lleva por delante a la mayoría de los pacientes que la sufren. El reducido número de personas que viven con hipertensión pulmonar es una prueba de su virulencia, no de su incidencia. De cualquier modo, su hija se estaba muriendo, así que Martine decidió plantarse ante el asesino.
Los médicos le dijeron que su quimera era imposible. Y hubo muchos médicos. Pero Martine también tenía mucho tiempo entre tantas visitas a tantos médicos; un tiempo que pasaba, en la mayoría de los casos, en una biblioteca especializada en medicina. Martine tenía su propio sistema: encontrar un artículo sobre hipertensión pulmonar en una revista médica, buscar la terminología desconocida en un manual universitario, consultar las ideas más importantes en un libro de texto escolar, mucho más genérico, y volver a repetir todo el proceso.
Y repetirlo una vez más.
Martine no recuerda el momento en que se propuso hacer realidad un sueño imposible: tratar una dolencia incurable en menos tiempo del que necesitaba la enfermedad para acabar con la vida de su hija. Pero aquello ya era algo habitual para Martine. Para cuando empezó a interesarse por la hipertensión pulmonar, Martine Rothblatt ya había hecho realidad un par de sueños imposibles.
Hoy en día, Martine Rothblatt es una de las consejeras delegadas mejor pagadas de Estados Unidos. ¿Cómo consiguió llegar hasta ahí? Esa historia es aún más interesante.
Martine nació como Martin, un chico judío de un barrio latino de Chicago. De mayor no quería ser nada espectacular, al menos por aquel entonces. Primero dejó la universidad y después se dedicó a dar vueltas por el mundo con una mochila a la espalda. Pero un encuentro fortuito con un sistema de seguimiento de la NASA en las islas Seychelles le dio una idea bastante descabellada: unir al mundo entero a través de las comunicaciones por satélite.
Martin, como Martine, era una persona ambiciosa. Su visión en las Seychelles le llevó a matricularse en la UCLA para sacarse una doble licenciatura en derecho y gestión de empresas. Buscó a personas que dominaran el campo del derecho espacial, lo que marcó el punto de partida de varias empresas dedicadas a las comunicaciones por satélite. Entre ellas, hay que destacar la primera emisora radiofónica global por satélite y Sirius XM, que todavía es el líder absoluto de la radio vía satélite, y que Rothblatt fundó con otros socios en 1990.
Durante todo este proceso, Martin se casó, tuvo una hija llamada Jenesis, se divorció, se volvió a casar, tuvo dos hijos más y, entonces, decidió que estaba atrapado en un cuerpo que no era el suyo. Así que Martin se lanzó a por su segundo sueño imposible, una operación de cambio de sexo, y se convirtió en Martine, y todo ello sin separarse de su mujer. De hecho, han seguido felizmente casados.
Pero entonces Jenesis se puso enferma.
Martine vendió su participación en Sirius. Y dedicó ese dinero a buscar un remedio para la enfermedad. Al final del proceso, encontró un medicamento huérfano para la hipertensión pulmonar. Glaxo poseía la patente, pero había decidido archivar la investigación. Martine formó un equipo de científicos y consiguió la autorización para trabajar con el «medicamento»; aunque utilizar esta palabra es en realidad un eufemismo. Lo que en realidad consiguió de Glaxo fue una bolsa de plástico que contenía unas cuantas cucharadas de un polvo blanco que —en pruebas con ratas— había demostrado resultados prometedores años atrás.
Aun así, decidió crear United Therapeutics. 2
Un centenar de químicos de primer nivel dijeron que la patente no se convertiría jamás en un medicamento, pero tres años después, cuando la hija de Martine luchaba por sus últimas bocanadas de aire, el fármaco llegó al mercado. Hoy Jenesis tiene más de treinta años, el medicamento que le salvó la vida genera unos ingresos de mil quinientos millones de dólares anuales, que van a las arcas de United Therapeutics, y el número de pacientes que conviven con la hipertensión pulmonar ha pasado de dos mil a cuarenta mil. 3
Si pusiéramos aquí el punto final, la historia ya sería digna de contarse. Pero el medicamento de Martine sólo era una solución a medias. Trataba la enfermedad, pero no la curaba. De hecho, en la actualidad, la única solución para la hipertensión pulmonar —o, para el caso, la fibrosis pulmonar, la fibrosis quística, el enfisema o la EPOC— es un trasplante de pulmón. Pero, en Estados Unidos, sólo hay unos dos mil pulmones disponibles al año, 4 mientras que medio millón de personas mueren por insuficiencia respiratoria vinculada a las enfermedades relacionadas con el tabaco. 5 Estos datos tan nefastos fueron el origen de otro de los sueños imposibles de Martine: crear un suministro ilimitado de órganos trasplantables.
«Lo hacemos continuamente con los coches y los edificios —explica Martine—, cambiamos las partes viejas por otras nuevas y podemos hacer que las cosas sigan funcionando, en realidad, para siempre. Quería encontrar un modo de hacer lo mismo con el cuerpo humano.»
Así que trazó un plan con tres líneas de actuación para resolver el problema. Primero, para resolver el problema del trasplante, decidió que era mejor no volver a inventar la rueda. Hoy en día, como los pulmones de las personas fallecidas están llenos de residuos tóxicos, más del 80 por ciento de los órganos donados acaban en la basura. 6 Así que Martine decidió perfeccionar un sistema para conservar los pulmones en buen estado cuando se extraen del cuerpo, en lo que se conoce técnicamente como «perfusión pulmonar ex vivo». 7 Actualmente, este procedimiento ya ha salvado miles de vidas, pero, una vez más, Martine no tenía suficiente. 8
Acto seguido, Martine abordó el gran problema de la escasez de órganos con el xenotrasplante. 9 Es una idea tan antigua como polémica —extraer órganos vivos de animales para reemplazar órganos humanos que ya no funcionan—, pero los problemas de zoonosis, rechazos y maltrato animal la habían dejado aparcada. Martine decidió recuperarla de nuevo.
Los órganos de los cerdos son muy similares a los de los seres humanos, por lo que decidió empezar por ahí. Formando equipo con Synthetic Genomics y Craig Venter, el mismo científico que descodificó el genoma humano, Martine elaboró el mapa genético del cerdo más completo realizado hasta la fecha. 10 Después, el CRISPR desactivó todos los genes relacionados con los virus, para eliminar la posibilidad de contagio de enfermedades y crear así un cerdo «limpio». Su último objetivo hasta hoy es el más ambicioso: desactivar los genes que provocan el rechazo del órgano en humanos. Si tiene éxito, habrá conseguido un suministro casi infinito de órganos; aunque a costa del sufrimiento de los cerdos.
Para combatir este último problema, Martine está utilizando nuevas técnicas de fabricación de tejidos orgánicos en un intento de prescindir por completo de los animales. A partir del colágeno, ha empezado a imprimir en 3D un armazón pulmonar artificial. 11 Para transformar ese armazón en un pulmón vivo, está haciendo experimentos con células madre.
Y, para terminar, como en muchos casos se tarda demasiado en transportar el órgano desde su ubicación original hasta el paciente en lista de espera, Martine ha apostado por el coche volador de Beta Technologies. La idea es usar estos vehículos, de cero emisiones, para llevar rápidamente esos órganos recién acuñados a los pacientes que los necesiten. 12 Finalmente, a los sesenta años, y por simple diversión, ella misma se convirtió en piloto de helicópteros. Poco después, en un vehículo diseñado por su empresa, estableció un nuevo récord de velocidad a bordo de un helicóptero eléctrico. Dicho esto, Martine cree que, en algún momento del año 2028, más o menos, la muerte por fallo orgánico será un problema que podremos manejar, más que una triste realidad de la vida. Y tenemos tantas razones para creerla como las que nos dan esos siete sueños imposibles.
De la atención a la enfermedad a la atención
a la salud
Probablemente no sea necesario añadir que el insólito asalto de Martine Rothblatt al sector de la asistencia médica contó con la complicidad y la ayuda de las exponenciales convergentes. CRISPR, genómica, células madre, impresión en 3D, vehículos eléctricos... Y la lista sigue. Pero resulta útil recordar que, a pesar de que la historia de Martine es una prueba de lo que la determinación y la tecnología pueden llegar a hacer, sólo es una historia. Hay mil más, quizá no tan extraordinarias, pero igual de impactantes.
En cuanto a la atención médica, muchas veces el sistema está más enfermo que los propios pacientes. Incluso la terminología resulta confusa. Hoy, ir al médico significa practicar la atención a la enfermedad. No a la salud. Es reactiva, no proactiva. Los médicos intervienen después de los hechos, librando una batalla en la retaguardia que suele ser ineficiente, muy cara y, en ciertos casos, directamente surrealista. En Estados Unidos, por ejemplo, el miedo a la mala praxis hace que los médicos se gasten 210.000 millones de dólares anuales en pruebas y tratamientos que los pacientes no necesitan. 13
En cuanto a la investigación, la situación tampoco mejora demasiado. De cada cinco mil nuevos medicamentos, sólo cinco llegan a la fase de ensayo con humanos, y sólo uno se acaba aprobando para su comercialización. 14 Ésta es la razón por la que un medicamento estándar tarda doce años en salir del laboratorio y llegar al paciente, con un coste de 2.500 millones de dólares. Por otro lado, los estadounidenses gastan una media de 10.739 dólares por persona y año en atención médica; más que cualquier otro país de la Tierra. 15 , 16 Si nada cambia, para 2027, sólo este sector consumirá cerca del 20 por ciento del PIB de Estados Unidos. 17
Pero ya están cambiando muchas cosas. El alcance de esta historia es enorme. Si quisiéramos, podríamos llenar varios libros con todo lo que está pasando. Pero, para poder abarcarlo todo, nos vamos a centrar en seis grandes cambios, cuatro de los cuales son tecnológicos, mientras que los dos últimos corresponden a cambios de paradigmas.
En el frente tecnológico, todas las etapas de los tratamientos médicos están en plena reinvención. En un primer nivel, la convergencia de sensores, redes e IA está cambiando drásticamente el diagnóstico médico. En un nivel intermedio, la robótica y la impresión en 3D están cambiando la naturaleza de los procedimientos médicos. Y, en un nivel más profundo, la IA, la genómica y la informática cuántica están transformando la medicina como tal.
Al mismo tiempo, como resultado de estas convergencias, se están produciendo dos grandes cambios de paradigma. El primero es el paso de la atención a la enfermedad a la atención de la salud; de un sistema retrospectivo, reactivo y genérico, a otro que es prospectivo, proactivo y personalizado.
El siguiente es un cambio en la gestión. Durante la mayor parte del último siglo, el sector de la atención sanitaria consistió en una compleja alianza entre las grandes farmacéuticas, los grandes gobiernos y el conjunto de los profesionales de la medicina, la enfermería y otras ramas del sector. Ahora somos testigos de una invasión. Muchas de las grandes empresas tecnológicas están entrando en el juego, y todas con la intención de causar un gran impacto. «Si miraras el futuro desde lejos —decía hace poco el consejero delegado de Apple, Tim Cook (en la misma entrevista con The Independent en la que hablaba del potencial de la RA)— y preguntaras cuál ha sido la gran contribución de Apple a la humanidad, la respuesta tendría que ver con la salud.» 18
Compitiendo con Apple tenemos a Google, Amazon, Facebook, Samsung, Baidu, Tencent y muchas otras. 19 Como veremos en un momento, todas estas empresas tienen tres grandes ventajas sobre el establishment : ya están en tu casa, metidas en la inteligencia artificial, y son expertas recopilando y analizando tus datos. Aunque la pregunta de si queremos entregar la atención médica a las grandes empresas tecnológicas aún no tiene respuesta, lo que está claro es que estas tres ventajas son fundamentales para detectar cualquier enfermedad con la suficiente antelación como para marcar una verdadera diferencia, lo que, sin duda, sería el primer paso para poder transformar la atención a la enfermedad en la atención a la salud.
Diagnósticos hágalo-usted-mismo
En un miércoles invernal de enero de 2026 te están vigilando. Vigilando atentamente. En realidad, estás dormido en tu cama, pero el asistente domótico de Google conoce tus horarios. Gracias a tu anillo Oura, también sabe que acabas de completar un ciclo REM y que ahora estás entrando en la Fase I del sueño, por lo que es el momento perfecto para despertarte. 20
El suave ascenso de la luz de la habitación simula la salida del sol, mientras que la optimizada longitud de onda de esa misma luz maximiza la vigilia y mejora el estado de ánimo. Para cuando ya has pasado por tu ritual de aseo —ir al baño, lavarse los dientes, etcétera— te das cuenta de que tu humor no es el problema. Es esa rigidez en las articulaciones, el frío que sientes en los huesos.
¿Te estás poniendo enfermo?
Los National Institutes of Health (NIH) lanzaron su vacuna universal de la gripe hace unos pocos meses, pero entonces no tuviste tiempo para que te pusieran la inyección. Ahora te estás preguntando si saltarte la vacuna fue una buena idea.
Pero no hace falta que te lo preguntes.
—Ey, Google, ¿qué tal voy de salud esta mañana?
—Un momento —dice tu asistente digital.
El diagnóstico se realiza en treinta segundos, lo que está bastante bien teniendo en cuenta que el sistema despliega docenas de sensores que capturan gigabytes de datos. Sensores inteligentes en el cepillo de dientes y el baño, ponibles en la cama y en la ropa, implantes dentro de tu cuerpo; un paquete de salud completo con una visión de 360 grados de todo tu sistema.
—Tu microbioma parece estar en perfecto estado —te dice Google—. Los niveles de glucosa en sangre también están bien, niveles de vitaminas adecuados, pero el aumento de la temperatura corporal y de los niveles de IgE...
—Google, ¿en román paladino?
—Tienes un virus.
—¿Un qué?
—Acabo de repasar tus últimas cuarenta y ocho horas de reuniones. Parece que te contagiaste el lunes, en la fiesta de cumpleaños de Jonah. Me gustaría hacerte más pruebas; ¿te importaría usar el...?
Escoge el que quieras. La división sanitaria de Alphabet, llamada Verily Life Sciences, está desarrollando una amplia variedad de sensores internos y externos que lo monitorizan todo, desde la glucosa en sangre hasta el hemograma. Y esto sólo en Alphabet. La lista de los aparatos médicos que costaban millones de dólares y que ahora están pasando por el proceso de desmaterialización, desmonetización, democratización y deslocalización —o sea, que se convertirán en sensores portátiles, e incluso ponibles— podría llenar un libro entero.
Veamos el amplio abanico de posibilidades. En su vertiente más espectacular, tenemos la cámara de ultrasonidos en 3D de Exo Imaging, que es barata, portátil y está basada en IA; es decir, que pronto vas a poder monitorizarlo todo, desde la cicatrización de una herida hasta el crecimiento del feto, y desde la comodidad de tu casa. 21 O fíjate en Openwater, la empresa emergente de la antigua jefa de proyecto de Google X, Mary Lou Jepsen, que está usando la holografía láser para crear un equivalente portátil de la Imagen por Resonancia Magnética (IRM), convirtiendo lo que hoy es una máquina de millones de dólares en un dispositivo electrónico que cualquiera puede llevar encima; una innovación que podría acercar el diagnóstico por imagen a las tres cuartas partes del mundo que hoy no tienen acceso a esta tecnología. 22 Sin embargo, otros inventos mucho más simples pueden llegar a ser mucho más revolucionarios.
En menos de dos décadas, los ponibles han evolucionado muchísimo, desde aquella primera generación de contadores de pasos al iWatch de Apple, que en su cuarta generación incluye un ECG aprobado por la FDA que puede monitorizar tu ritmo cardiaco a tiempo real. 23 O el DxtER de Final Frontier Medical Devices, el ganador de los diez millones de dólares del Qualcomm Tricorder XPRIZE, una combinación de sensores no invasivos y de una IA muy fácil de usar accesible a través de una app. 24 DxtER detecta de manera fiable más de cincuenta enfermedades comunes.
Todas estas innovaciones apuntan hacia un futuro en el que la salud estará sometida a un control constante y los diagnósticos serán sencillos y baratos. El nombre técnico que recibe esta evolución es «salud móvil», un sector que, según las previsiones, se convertirá en un mercado de 102.000 millones de dólares en 2022. 25 Hazte a un lado, Doctor Web. La idea es ponerte un médico virtual, a la carta, en el bolsillo del pantalón.
Y nos estamos acercando. A lomos de la convergencia entre las redes, los sensores y la informática, los chatbots médicos basados en IA están inundando el mercado. Estas aplicaciones pueden diagnosticarlo todo, desde un eczema hasta la retinopatía. Y no sólo enfermedades físicas. Woebot se ocupa de la salud mental y ofrece terapia conductual cognitiva a través de Facebook Messenger a los pacientes que sufren de depresión. 26
Pero, en realidad, ¿adónde nos llevan todas estas innovaciones?
Veamos, por ejemplo, el caso de Human Longevity Inc. (HLI), una empresa que tiene a Peter entre sus fundadores. HLI ofrece un servicio llamado «Health Nucleus», un chequeo anual de tres horas de duración que incluye una secuenciación completa del genoma, una resonancia magnética de cuerpo entero, tomografía computarizada de pulmón y corazón, electrocardiograma, ecocardiograma y un análisis de sangre exhaustivo; en resumen, el examen de salud más completo que pueda realizarse.
Este examen es importante por dos razones. La primera es la detección precoz de enfermedades. En 2018, Human Longevity publicó los datos de sus 1.190 primeros clientes. 27 Un 9 por ciento de los pacientes descubrieron que tenían una enfermedad cardiovascular de la que no tenían noticia (la primera causa de muerte en el mundo), un 2,5 por ciento encontró aneurismas (la segunda), un 2 por ciento tenían tumores, etcétera. En total, el 14,4 por ciento de los pacientes tenía problemas importantes que requerían una intervención inmediata, mientras que otro 40 por ciento descubrió la presencia de una patología que precisaba de un seguimiento a largo plazo.
¿La segunda razón por la que importa? Todas esas variables que Human Longevity mide y escanea durante una visita anual que requiere media jornada de trabajo pronto estarán disponibles cuando a ti te apetezca. Gracias a unos sensores que siempre estarán activos, siempre en estado de alerta, tu móvil está a punto de convertirse en tu médico personal.
Leer, escribir y modificar el código de la vida
Durante toda una década, los expertos han anunciado a los cuatro vientos que la genética personalizada sería una revolución en la medicina. Cuando comprendamos tu genoma, decía el razonamiento, sabremos cómo podemos «optimizarte». Sabremos cuáles son tus fármacos perfectos, tu alimentación perfecta y tu régimen de ejercicios perfecto, sólo para ti. Conoceremos qué clase de flora intestinal es la más adecuada para tu microbioma, qué suplementos combinan mejor con tu fisiología. Conocerás las enfermedades que puedes contraer con mayor facilidad y, sobre todo, la manera de prevenirlas. O al menos eso decía la teoría...
En 2017, Jason Vassy, profesor de medicina en el Hospital Brigham and Women de Boston, decidió analizar a fondo esa teoría. 28 Y pidió la colaboración de un centenar de pacientes. A la mitad se les hizo un análisis de ADN; el resto respondió a un cuestionario sobre el historial médico de su familia, que es el método habitual para determinar los riesgos genéticos. A partir de los resultados, Vassy quería comparar la ansiedad asociada a los análisis de ADN con su verdadera utilidad en el mundo real. Los detractores de la genética personalizada critican la sobrecarga de información que reciben los médicos, la innecesaria ansiedad que genera en los pacientes y la cantidad de pruebas de seguimiento que hay que hacer después, tan caras como innecesarias. Pero eso no es lo que Vassy descubrió.
Al contrario, según los resultados publicados en Annals of Internal Medicine , no había ni rastro de todas esas cuestiones tan criticadas. 29 Lo que ocurrió es que el 20 por ciento de los pacientes que pasaron por el análisis de ADN descubrieron que tenían enfermedades raras, potencialmente mortales, que requerían una intervención inmediata. De nuevo, gracias a unos resultados muy similares a los obtenidos por Health Nucleus, fue posible salvar varias vidas.
Pero el resultado más importante no proviene de las pruebas realizadas a un solo paciente, sino de la combinación de todos los genomas. Cuanto más grande y completa sea nuestra base de datos, más fuerte y robusta será la capacidad preventiva de la genética. Ésta es la razón por la que, en 2018, los National Institutes of Health lanzaron el proyecto «All of Us», que repartió unos veintisiete millones de dólares en subvenciones para secuenciar un millón de genomas. 30 Y lo mismo podría decirse de George Church, un genetista de Harvard, que hace poco ha creado la empresa Nebula Genomics para hacer algo similar. 31
Church también está involucrado en el Genome Project-Write, que simboliza el futuro a largo plazo; el proyecto trata de escribir un genoma humano desde cero. Si tiene éxito, el GP-Write —el nombre por el que se conoce el proyecto— nos ayudará a crear órganos trasplantables, nos proporcionará nuevas armas en la guerra contra los virus y el cáncer y nos ofrecerá fármacos y vacunas mucho más baratos.
El uso del CRISPR para editar genomas es la nueva frontera. Todavía es pronto, pero los avances son impresionantes. Recientemente, varios grupos de investigadores han conseguido crear una resistencia genética a la cocaína en ratones, 32 desactivar el gen responsable de la distrofia muscular de Duchenne en perros 33 y han empezado a desarrollar terapias personalizadas contra el cáncer en humanos. 34 Hay incluso investigaciones en insectos. Los investigadores del Imperial College de Londres han «CRISPRcreado» una nueva variedad de mosquito que no puede reproducirse. Está diseñado para vencer a sus hermanos portadores de la malaria, lo que convierte a este hallazgo en toda una revolución médica gracias a la modificación genética de las especies; algo que ya está ocurriendo. A finales de 2018 se realizaron los primeros ensayos sobre el terreno en Burkina Faso, un país asolado por la malaria. 35
Pero la noticia más importante no tiene que ver con esta empresa o aquella técnica, sino con que la mitad de los treinta y dos mil trastornos genéticos más habituales tienen su origen en el error de un único par base; es decir, que una sola letra del código está en el lugar incorrecto. 36 Es muy probable que pronto podamos resolver este problema. Aún no hemos llegado a ese punto, pero antes de que pase demasiado tiempo, entre la terapia génica tradicional y el CRISPR, tendremos la capacidad de eliminar dieciséis mil enfermedades de nuestras vidas. 37 Así pues, tendrías que hacerte una pregunta: si la cura de una enfermedad es un milagro de proporciones bíblicas, ¿cómo llamarías a la cura de dieciséis mil?
El futuro de la cirugía
En Marte no hay atención médica. El planeta rojo carece de hospitales, mutuas de salud y todo lo demás. Y aunque hoy todo esto no tiene la menor importancia, en la década de 2030, cuando la NASA planea lanzar la primera misión de exploración tripulada al planeta, se convertirá en un problema mucho más importante. 38 En Marte, los astronautas no sólo estarán fuera de cobertura, estarán fuera del mundo: el hospital más cercano se encontrará a una distancia de nueve meses de viaje y una asistencia gravitatoria.
La posibilidad de sufrir una herida traumática quita el sueño a cualquier astronauta. No sólo es una situación que no ha ocurrido nunca —por lo que no tenemos ninguna experiencia sobre esta catástrofe espacial en particular—, sino que además sabemos a ciencia cierta que en Marte seguro que se producirá. Varias investigaciones sitúan las probabilidades de sufrir un problema médico grave en el espacio en el 0,06 por ciento, por persona y año. 39 En una misión interplanetaria que durara varios años, y para conseguir que no hubiera ningún accidente, la única solución, tal como explicaba Elon Musk, sería ésta: «Si la seguridad es tu primer objetivo, yo optaría por no ir a Marte». 40
El doctor Peter Kim quiere resolver este problema. Como jefe adjunto de cirugía del Children’s National Medical Center de Washington, DC, Kim forma parte del equipo de investigación que está detrás del STAR, el Smart Tissue Autonomous Robot [robot autónomo para tejidos blandos]; un robot que ya supera a los cirujanos humanos en la tarea concreta de suturar tejidos blandos. 41
Reparar tejidos blandos es desagradable. Es sangriento. Y exige una precisión milimétrica. Como los médicos no poseen el mismo nivel de pericia y formación, más del 30 por ciento de las intervenciones en los tejidos blandos terminan en complicaciones. En el espacio, este tipo de complicaciones pueden llegar a ser fatales con mucha facilidad, por lo que descubrir cómo realizar intervenciones en los tejidos blandos antes de empezar a colonizar otros planetas es una misión fundamental.
STAR es una de nuestras mejores esperanzas. Para empezar, la pericia está estandarizada; viene de fábrica. Y con una IA involucrada, la formación y las prácticas no son un problema. Hoy STAR sutura el tejido entre cinco y diez veces más rápido que un humano, y con mucha más precisión. La versión del mañana tendrá un control de movimiento mucho más realista y una amplia variedad de cámaras multiespectrales que pueden ver a través de los tejidos blandos. Kim quiere que ese sistema del mañana viaje a bordo de la primera misión a Marte para que la práctica de la cirugía en el espacio no acabe como una recopilación de las escenas eliminadas de Alien.
Aun así, y a pesar de que en el espacio resultará imprescindible, el verdadero futuro de STAR se encuentra aquí, en la Tierra. Cada año se realizan unos cincuenta millones de operaciones en Estados Unidos, 42 pero menos del 5 por ciento se completan con la ayuda de un robot. 43 Sin embargo, la pregunta más importante que puedes hacerle a un cirujano antes de una operación siempre será «¿cuántas veces has hecho esta intervención?». Y, más importante todavía, «¿cuántas veces la has hecho hoy?». Los cirujanos que acumulan una mayor experiencia en todo tipo de situaciones son los que obtienen mejores resultados. Ésta es la razón por la que, dentro de diez años, cuando te lleven al quirófano y veas a un médico humano, tu respuesta inmediata será: «Ni hablar. Quiero al robot».
Pronto tendremos docenas de robots quirúrgicos en el mercado. Hoy ya se utilizan unos modelos espectaculares para operaciones ortopédicas, también están a punto de lanzarse cinco robots diferentes para cirugía medular y hay infinidad en desarrollo para casi cualquier especialidad. De estos últimos, la mayoría son «cobots», es decir, robots que, en vez de sustituir al cirujano, prefieren echarle una mano. Sin embargo, son los robots autónomos como STAR los que parecen más prometedores. Por su capacidad para ejecutar a la perfección procedimientos rutinarios por una fracción del coste actual, los robo-cirujanos van a traer la desmonetización a la sala de operaciones.
Renuentes a dejar que los emprendedores acaparen toda la diversión, las grandes empresas tecnológicas también se apresuran con la idea de sumarse a la fiesta. Prueba documental 1: Verb Surgical, una colaboración entre Alphabet y Johnson & Johnson. 44 Con una flota de robots quirúrgicos baratos y mejorados, que llegarán al mercado en 2020, su modesto y declarado objetivo es lograr la «democratización de la cirugía». ¿Qué significa esa idea en otras palabras? Que la factura médica va a rebajarse muchísimo.
Aunque los robots quirúrgicos de gran tamaño han acaparado toda la atención, sus primos más pequeños podrían convertirse en el invento verdaderamente revolucionario. Fíjate en la empresa emergente israelí Bionaut Labs. 45 En la medicina actual, muchos de los problemas contra los que nos enfrentamos tienen una naturaleza local. El cáncer, por ejemplo. Hablamos de cáncer de pulmón o de cáncer de ovario. Pero, lamentablemente, solemos tratar los cánceres locales con soluciones sistémicas, como la quimioterapia. Estos tratamientos sistémicos tienden a ser imprecisos, ineficientes y propensos a causar efectos secundarios; las tres razones por las que el desarrollo de medicamentos es extraordinariamente caro y el 90 por ciento de todos los potenciales tratamientos nunca consiguen salir del laboratorio. 46
Pero Bionaut ha fabricado un robot de un tamaño casi microscópico que se mueve a través de los tejidos a una velocidad encomiable —unos sesenta centímetros por hora— y de una forma mínimamente invasiva y muy precisa. Guiados por campos magnéticos muy débiles, estos microbots por control remoto transportan cargas diversas que pueden liberarse a voluntad, donde y cuando sean necesarias. Aún faltan años para que su uso se extienda, pero el plan es poder utilizarlos para hacer diagnósticos, aplicar tratamientos muy precisos y realizar operaciones mínimamente invasivas.
Los macrobots de los quirófanos y los microbots de nuestros cuerpos van a transformar la cirugía, pero en nuestro universo convergente nada funciona solo. La IA ya forma parte de este combinado quirúrgico. Analiza la avalancha de señales que llegan a la UCI, ayuda a los robots autónomos mientras navegan por el cuerpo humano y —a través de cobots, como el robot Da Vinci— acaba con los temblores de manos del cirujano. 47 Pero, una vez más, no sólo es una cuestión de IA.
La impresión en 3D también ha llegado al quirófano. De hecho, desde hace cierto tiempo. En Abundancia , explicábamos que la tecnología ya se aplicaba en el campo de la ortopedia, que empezaba a utilizarse para imprimir órganos y que en poco tiempo llegaría a la biónica. Hoy en día, una búsqueda en internet revela la existencia de personas con escasa formación capaces de crear miembros ortopédicos excepcionalmente funcionales con materiales comprados en Staples. 48 Las personas que sí tienen formación, mientras tanto, están confeccionando órganos, orejas, médulas espinales, baipases coronarios, placas craneales, articulaciones de cadera y herramientas quirúrgicas personalizadas. Y gracias a la posibilidad de imprimir dispositivos electrónicos en 3D, también estamos fabricando miembros biónicos. De hecho, en 2018, un equipo de la Universidad de Minnesota imprimió con éxito un material semiconductor capaz de transformar la luz en patrones reconocibles; el principal impedimento para crear la pieza de recambio definitiva: un ojo biónico e imprimible. 49
Medicina celular
El concepto de «medicina celular» surgió en la década de 1990, tras el descubrimiento de las células madre. 50 Original y sencilla a la vez, la idea consistía en usar esas células como armas contra las enfermedades. En los años siguientes, la definición también ha incluido a otros tipos de células —además de las células madre— que, en distinto grado, pueden condicionar o revitalizar una variedad de funciones: hacer crecer el cabello, rejuvenecer tejidos, acabar con el cáncer, reparar el daño cardiaco, silenciar las enfermedades autoinmunes e incluso aumentar la masa muscular.
Anteriormente ya hemos mencionado al neurocirujano y emprendedor Bob Hariri, quien realizó una importante contribución a la medicina celular en el año 2000, cuando descubrió que la placenta humana almacena un abundante suministro de células madre, lo que permite acceder al ingrediente fundamental de estas terapias sin polémicas ni controversias. 51
Después de que el gigante farmacéutico Celgene comprara la empresa de Hariri, se puso al mando de un equipo de más de cien científicos e ingenieros para intentar convertir las células madre de la placenta en verdaderos medicamentos. Por el camino, ha hecho dos descubrimientos fundamentales. Primero, a medida que la gente envejece, su suministro de células madre disminuye rápidamente, un proceso conocido como «agotamiento de las células madre» (que veremos con mayor profundidad en el próximo capítulo). Segundo, la placenta también almacena otros tipos de células que forman parte del sistema inmunológico, como las células NK (del inglés «Natural Killer») y los linfocitos T, que resultan fundamentales en la respuesta natural del cuerpo contra el cáncer... siempre que reconozcan el peligro.
Normalmente, nuestro sistema inmune destruye las células cancerígenas en sus primeras etapas. Pero, a medida que vamos envejeciendo, esas células cancerígenas se van acumulando. Algunas no son detectadas, y ahí es cuando la situación se vuelve peligrosa. Para contrarrestar ese peligro, hemos inventado una nueva clase de terapia llamada terapia CAR-T (por antígeno receptor de linfocito T quimérico). 52 En esta terapia, se extraen glóbulos blancos del paciente para separar sus linfocitos T y rediseñarlos genéticamente con el objetivo de detectar y matar a un tipo concreto de células cancerígenas. Estas células reprogramadas vuelven a inyectarse al paciente, donde se convierten en una especie de misil anticancerígeno guiado por radar.
Por desgracia, este procedimiento no sale barato.
En 2017, cuando se desarrollaron las primeras terapias CAR-T, el precio llegaba al medio millón de dólares por paciente. 53 Como es necesario rediseñar las células CAR-T de cada paciente, producir este «medicamento» en serie representa todo un problema. En 2018, Celgene inauguró su división de medicina celular, con Hariri al timón, y mediante el uso de células inmunitarias derivadas de la placenta, una nueva empresa, Celularity, ha creado una versión de la terapia válida para todo el mundo (o sea, en talla única). 54 En vez de terapias hechas a medida, Celularity puede crear CAR-T al por mayor y a una velocidad de vértigo, para así suministrar el fármaco al paciente horas después del diagnóstico, y no semanas más tarde como ocurre ahora.
Los científicos de Celularity también han encontrado la forma de rearmar a las células NK placentarias (células pNK), modificándolas genéticamente para que se conviertan en células CAR-NK con una capacidad anticancerígena muy mejorada. Y como ocurre con las células placentarias CAR-T, las células placentarias CAR-NK pueden transformarse en medicamentos aptos para todo el mundo, lo que nos brinda la capacidad de preparar tratamientos destinados al gran público. Ésta es la cuestión más importante. El cáncer es la segunda enfermedad más mortífera, y las placentas abundan. Cada año hay más de cien millones de nacimientos, y el 99 por ciento de esas placentas se desechan. Conservar esa materia prima nos daría el potencial de manufacturar todos estos medicamentos de forma barata y a gran escala.
El futuro de los medicamentos
Tradicionalmente, si una empresa farmacéutica quiere desarrollar un nuevo medicamento, tiene dos opciones. 55 O peina las enormes bibliotecas médicas buscando potenciales candidatos o envía una expedición a un destino exótico a la caza de los tratamientos que nos ofrece la naturaleza, como la corteza de una especie de árbol que tenga propiedades anticancerígenas. Ninguna de las dos opciones es una apuesta segura, ambas implican años de trabajo, y todo lo anterior no es más que la línea de salida. Después de identificar a los posibles candidatos, se analizan y se sintetizan..., y así los años van pasando. Por último, los hallazgos se someten a ensayos clínicos, primero en animales, después en pequeños grupos de personas y, al final, en grandes grupos humanos. En resumen, el desarrollo de un nuevo medicamento es una guerra larga y lenta.
Es una guerra real. El recuento de bajas es elevado. Un 90 por ciento de los potenciales tratamientos no superan las pruebas. Los pocos que lo consiguen tardan de media unos diez años en llegar al mercado, después de dejarse entre 2.500 y 12.000 millones de dólares en el viaje. 56 Pero Alex Zhavoronkov, un informático reconvertido en biofísico cree que ha encontrado un atajo. 57
En 2012, Zhavoronkov se dio cuenta de que la inteligencia artificial empezaba a reconocer la imagen, la voz y el texto con una mayor precisión. Sabía que estas tres tareas comparten un elemento fundamental. En cada una de ellas, la cantidad de datos existente es desbordante, por lo que entrenar a una IA resulta muy sencillo. En el campo de la farmacología, también existen conjuntos de datos similares. Así que, en 2014, Zhavoronkov empezó a preguntarse si podía combinar todos esos datos con una IA para acelerar significativamente el proceso de desarrollo de nuevos medicamentos. 58
Había oído hablar de una nueva técnica en el campo de la inteligencia artificial llamada «redes antagonistas generativas» (o GAN por sus siglas en inglés). Al confrontar dos redes neuronales entre sí (antagonistas), el sistema puede empezar a operar con unas instrucciones mínimas y producir resultados nuevos (generativas). Los investigadores usan las GAN para hacer cosas como diseñar nuevos objetos o crear rostros humanos tan únicos como falsos, pero Zhavoronkov quería aplicarlas a la farmacología. Creía que las GAN permitirían a los investigadores describir las propiedades de los medicamentos verbalmente: «El compuesto debe inhibir la proteína X a una concentración Y con un mínimo de efectos secundarios en humanos», y entonces la IA puede construir la molécula desde cero.
Para conseguir que su idea se hiciera realidad, Zhavoronkov trasladó Insilico Medicine al campus de la Universidad Johns Hopkins, Maryland, y empezó a arremangarse. «Nos llevó tres años de duro trabajo desarrollar un sistema con el que los investigadores pudieran interaccionar de esta manera —explica—. Pero conseguimos sacarlo adelante, y esto nos ha permito reinventar el proceso de desarrollo de nuevos medicamentos.»
En vez de iniciar el proceso en algún destino exótico, el «motor de descubrimiento de medicamentos» de Insilico criba millones de muestras para determinar las características biológicas distintivas de enfermedades concretas. A continuación, el motor identifica los tratamientos que podrían ser más prometedores y —usando las GAN— genera moléculas (o sea, medicamentos en fase embrionaria) perfectamente adecuadas para los mismos. «Los resultados son una explosión de potenciales medicamentos y un proceso de ensayos clínicos mucho más eficiente —dice Zhavoronkov—. La IA nos permite hacer con cincuenta personas lo que una empresa farmacéutica tradicional hace con cinco mil.»
Los resultados han transformado lo que antes era una guerra de diez años en una escaramuza de unos pocos meses. A finales de 2018, por ejemplo, Insilico estaba generando moléculas nuevas en menos de cuarenta y seis días; un marco temporal que no sólo incluía el descubrimiento inicial, sino también la síntesis del medicamento y su validación experimental en simulaciones por ordenador. 59
En la actualidad, están usando el sistema para encontrar nuevos medicamentos contra el cáncer, la fibrosis, la enfermedad de Parkinson, el mal de Alzheimer, la esclerosis lateral amiotrófica (ELA) y muchas otras enfermedades. Está previsto que el primer medicamento creado a partir de este trabajo, un tratamiento para la alopecia, empiece la Fase I de ensayos clínicos a finales de 2020. También se encuentra en las primeras etapas de un estudio que quiere utilizar la IA para predecir los resultados de los ensayos clínicos antes de realizarlos. Si tiene éxito, esta técnica permitiría a los investigadores ahorrar una gran cantidad del tiempo y del dinero que ahora requieren los ensayos tradicionales.
Más allá de la invención de nuevos compuestos, otros equipos de investigadores utilizan la IA para identificar dianas biológicas; o sea, el lugar donde el fármaco se une al cuerpo, y que es una parte fundamental del proceso de desarrollo de cualquier medicamento. Entre 1980 y 2006, y a pesar de una inversión anual de 30.000 millones de dólares, los científicos sólo han podido descubrir una media de cinco dianas biológicas al año. 60
El problema es la complejidad. La mayoría de las dianas biológicas son proteínas, y su estructura —o sea, la forma en que una secuencia bidimensional de aminoácidos se pliega en una proteína tridimensional— determina su función. Pero una proteína que apenas cuenta con cien aminoácidos (es decir, una proteína bastante pequeña) puede adoptar una cantidad enorme de posibles formas; en concreto, tantas como un uno seguido de trescientos ceros. Por este motivo, el plegamiento de proteínas se considera un problema muy difícil de resolver, incluso para un gran superordenador.
En 1994, para monitorizar los avances de un superordenador en el plegamiento de las proteínas, se creó un concurso bianual. 61 Hasta 2018, las buenas noticias eran poco frecuentes. Pero, entonces, los creadores de DeepMind liberaron sus redes neuronales para resolver el problema. Crearon una IA que extrae enormes cantidades de datos para determinar la distancia más probable entre los pares base de una proteína y los ángulos de sus enlaces químicos —o sea, los componentes básicos del plegamiento de las proteínas—. La llamaron «AlphaFold». 62
En su primera aparición en la competición, las IA participantes tenían que resolver cuarenta y tres problemas de plegamiento de proteínas. AlphaFold consiguió resolver correctamente veinticinco. El equipo que quedó en segundo lugar sólo consiguió resolver tres.
Si combinamos los avances de AlphaFold con las GAN de Insilico y añadimos las próximas innovaciones en el campo de la informática cuántica —tecnología que también tiene como objetivo el desarrollo de nuevos medicamentos— no estamos tan lejos de un mundo donde la medicina personalizada dejará de ser ciencia ficción y se convertirá en la norma. Y no te vayas todavía, porque, por más radicales que puedan parecer estos avances, no incluyen todo lo que está ocurriendo en el campo adyacente de la longevidad.
Capítulo diez
El futuro de la longevidad
Los nueve jinetes del Apocalipsis
En un capítulo anterior hemos hablado de los cambios que tendrán lugar en el mundo debido al aumento de la esperanza de vida. La ecuación es muy sencilla: una vida más larga significa que tendremos más tiempo para aprovechar nuestro mejor momento en términos de productividad, lo que a su vez significa más innovación. Pero de lo que no hablamos fue de cómo ocurriría. Ahora, en el tramo final de nuestro análisis sobre la atención médica, queremos prestar especial atención a la cuestión de la longevidad para ver de qué modo las fuerzas de la convergencia están reescribiendo las normas de la competición entre la tecnología y la mortalidad.
El punto de partida: El propio concepto de mortalidad, ese reloj vital que llamamos envejecimiento. «El envejecimiento no sólo es un deterioro del sistema —explica el especialista en longevidad y director de los National Institutes of Health, Francis Collins—. 1 Es un proceso programado. Probablemente la evolución decidió invertir en que la esperanza de vida de una especie no fuera eterna. Tienes que quitar a los viejos de en medio para que los jóvenes tengan la oportunidad de acceder a los recursos.»
Para quitar a los viejos de en medio, la evolución diseñó un método a prueba de fallos: la obsolescencia programada, también denominada «envejecimiento». Es un plan redundante. En la actualidad, los científicos creen que hay nueve grandes «causas» que explican nuestro declive, los nueve jinetes de un apocalipsis interno. 2 Vamos a dedicar el resto del capítulo a investigar las estrategias que se están poniendo en marcha para vencer nuestra decadencia. Pero, antes de ponernos manos a la obra, primero tenemos que conocer a esos jinetes y estudiar la gran pregunta que nos plantean: ¿Qué es lo que nos mata exactamente?
1. Inestabilidad genómica : la replicación del ADN no siempre sigue el plan previsto. Normalmente, el cuerpo detecta los errores y los corrige, pero no siempre. Con el tiempo los errores se acumulan, un fenómeno que provoca que el cuerpo se desgaste; esto significa que la inestabilidad genética lleva al daño genético, lo que a su vez conduce a una limitación de la esperanza de vida. Es algo parecido a lo que ocurre con una fotocopiadora estropeada, salvo en que, en vez de producir páginas ilegibles, nuestra máquina averiada crea enfermedades como el cáncer, la distrofia muscular o la ELA.
2. Erosión de los telómeros : en el núcleo de la célula, el ADN se empaqueta en unas estructuras filiformes llamadas cromosomas. Los cromosomas están cubiertos por los telómeros, unos pequeños fragmentos de ADN que se repiten miles de veces. Estas repeticiones actúan como barreras —como los parachoques de un coche—, diseñadas para proteger el núcleo del cromosoma. Pero a medida que el ADN se replica, los telómeros se vuelven más pequeños. Cuando se han reducido tanto que ya no llegan a un umbral determinado, la célula deja de dividirse y nos volvemos mucho más susceptibles a la enfermedad.
3. Alteraciones epigenéticas : la naturaleza condiciona la longevidad. Durante el transcurso de una vida, los factores ambientales pueden alterar la expresión de nuestros genes, a veces para mal. La exposición a carcinógenos ambientales puede silenciar el gen que elimina los tumores, por ejemplo. Estas células empiezan a crecer descontroladamente y el resultado es el cáncer.
4. Pérdida de proteostasis : dentro de la célula, las proteínas dirigen el espectáculo. Transportan los materiales, envían señales, activan y desactivan ciertos procesos y proporcionan un soporte estructural. Pero las proteínas se vuelven menos eficientes con el paso del tiempo, por lo que el cuerpo las recicla. Por desgracia, a medida que vamos envejeciendo, podemos perder esta capacidad de reciclaje. Los basureros se ponen en huelga y sufrimos una acumulación de proteínas tóxicas que puede, por ejemplo, conducir a enfermedades como el mal de Alzheimer.
5. La detección de los nutrientes se estropea : el cuerpo humano depende de más de cuarenta nutrientes diferentes para conservar la salud. Para que todo funcione perfectamente, las células tienen que ser capaces de reconocerlos y procesarlos. Pero esta capacidad se deteriora según envejecemos. Por ejemplo, una de las razones por las cuales muchas personas ganan peso con la edad es que las células pierden la capacidad de digerir las grasas. Y una de las razones por las que enfermamos es que este proceso afecta a la insulina y al IGF-1 (el factor de crecimiento insulínico tipo 1), lo que puede causar diabetes.
6. Disfunción mitocondrial : la mitocondria es como una central eléctrica. Al convertir el oxígeno y el alimento en energía, suministra el combustible básico de nuestras células. Pero su rendimiento disminuye con el paso del tiempo. El resultado son los radicales libres, una forma de oxígeno muy dañina que estropea el ADN y las proteínas, y que causa muchas de las enfermedades crónicas asociadas al envejecimiento.
7. Senescencia celular : cuando las células sufren estrés, en ocasiones se vuelven «senescentes». Pierden su capacidad de dividirse y, al mismo tiempo, se vuelven resistentes a la muerte. Estas «células zombis» no pueden eliminarse del cuerpo. Con el tiempo se acumulan, infectan a las células vecinas y, en última instancia, desatan el apocalipsis zombi del debilitamiento celular.
8. El agotamiento de las células madre : según vamos envejeciendo, nuestra reserva de células madre cae en picado, en ciertos casos en múltiplos de diez mil. Y, aún peor, aquellas células a las que nos agarramos desesperadamente se vuelven menos activas. Esto significa que el sistema de reparación de órganos y tejidos que tiene nuestro cuerpo pierde la capacidad para hacer su trabajo.
9. Alteración de la comunicación intercelular : para que el cuerpo funcione correctamente, las células tienen que comunicarse. Es un proceso que ocurre de forma constante, mientras los mensajes circulan por nuestro torrente sanguíneo y los sistemas inmune y endocrino. Con el tiempo, las señales tienen interferencias. Algunas células dejan de responder, mientras que otras se convierten en células zombis que causan inflamación. Esta inflamación bloquea aún más la comunicación. Cuando esto ocurre, los mensajes ya no pueden pasar y el sistema inmune no puede encontrar los patógenos.
Y ahora que ya sabemos lo que nos está matando, vamos a ver lo que podría salvarnos.
La velocidad de escape de la longevidad
¿Quieres ganar un premio Nobel? Estudia las lombrices. Y no te pongas a estudiar cualquier lombriz. Estudia las lombrices intestinales, la Caenorhabditis elegans o, como la llaman sus amigos, C. elegans . 3
Una lombriz que tiene muchos amigos.
Seis científicos ya se han llevado a casa el premio sueco por su trabajo con esta criatura. De hecho, la C. elegans es el primer organismo que ha visto cómo se secuenciaban sus genes, se analizaba todo su genoma 4 y se cartografiaba su conectoma, el diagrama del cableado de sus neuronas. 5 Pero a pesar de tan celebrada historia, muchos creen que la mayor contribución de la lombriz intestinal aún tiene que llegar, porque la C. elegans es el primer animal que se ha enfrentado cara a cara a la muerte... y ha ganado.
En una placa de Petri, la C. elegans vive unos veinte días. En 2014, un grupo de científicos de los NIH, que trabajaban en el Buck Institute para la investigación sobre el envejecimiento, trataron de incrementar esta cifra. 6 Las investigaciones precedentes habían demostrado que había dos formas de obtener resultados. Eliminar un gen llamado rsks-1 incrementa la esperanza de vida en seis días; eliminar el daf-2, en cambio, la alargaba veinte días. Pero ¿qué ocurriría, se preguntaban los científicos, si eliminaban ambos genes a la vez?
«A partir de una hipótesis bien razonada, [los investigadores] calcularon que aquellos mutantes por partida doble podrían vivir hasta cuarenta y cinco días —escribía Francis Collins, director de los NIH, que financiaban el trabajo—. 7 Pero, para su sorpresa, cuando crearon esas lombrices mutantes, algunas todavía estaban vivitas y coleando cien días después. Estamos hablando de multiplicar su esperanza de vida por cinco, lo que equivaldría a ver seres humanos de cuatrocientos años.»
Aplicar este mismo proceso con el objetivo de alargar la esperanza de vida de los seres humanos representa la esencia misma del concepto de longevidad. La genética, por supuesto, juega un papel fundamental. Partiendo de los trabajos sobre la C. elegans, otros científicos han identificado más de cincuenta genes que parecen desencadenar el deterioro relacionado con la edad. 8 Cinco de esos genes parecen particularmente importantes, ya que eliminar uno solo de ellos produce un aumento del 20 por ciento en la esperanza de vida.
Pero la genética no lo es todo. La misión de Martine Rothblatt, que consiste en fabricar un suministro ilimitado de piezas de repuesto para el cuerpo humano, también resulta fundamental para la longevidad. Como también lo son la democratización de la cirugía que propone la robótica y los trabajos relacionados con el proceso de desarrollo de medicamentos mediante IA y ordenadores cuánticos. Pero aquí lo importante no es fijarse en una técnica en concreto, sino pensar en el poder combinado de todas estas innovaciones, que nos llevan hacia una dirección completamente nueva.
La dirección vieja era tener una esperanza de vida de treinta años, una cifra que se mantuvo constante desde el Paleolítico hasta el final de la Revolución Industrial. Durante el siglo XX , maravillas como los antibióticos, la higiene y el agua potable alargaron la media hasta los cuarenta y ocho años en 1950, y más adelante hasta los setenta y dos en 2014. 9 Pero, en la actualidad, Ray Kurzweil y el experto en longevidad Aubrey de Grey han empezado a hablar de la «velocidad de escape de la longevidad», o la idea de que, por cada año que vivamos, la ciencia será capaz de alargar nuestra esperanza más de doce meses. 10 En otras palabras, una vez que superemos este umbral, estaremos literalmente un paso por delante de la muerte.
Kurzweil cree que llegaremos a ese momento en doce años, mientras que De Grey lo sitúa dentro de treinta. ¿Por qué deberíamos creerlos? Un hecho irrefutable: No puedes llevarte nada al más allá. Todo el dinero del mundo no sirve de nada en la tumba. Así pues, ¿cuánto dinero están dispuestos a pagar los ricos por tener una o dos décadas más de vida? Muchísimo. Un detalle que ayuda a entender el reciente aumento del dinero invertido en tecnologías antienvejecimiento, con Calico de Google —Calico es un acrónimo de «California Life Company»— como el ejemplo más evidente. Más importante aún, aunque no parece que alargar la esperanza de vida de los ricos sea un objetivo por el que valga la pena luchar, y como ya hemos visto con otras tecnologías en fase de aceleración, no pasará mucho tiempo antes de que sus beneficios se desmoneticen y democraticen. Y esto significa que quizá tú, y tus hijos con total seguridad, tendréis el potencial de añadir alguna década adicional a vuestras vidas, simplemente porque, a medida que pasa el tiempo, todos nosotros nos tropezaremos por el camino con un buen número de tecnologías antienvejecimiento.
Ahora prestemos atención a las más prometedoras.
La farmacia antienvejecimiento
La isla de Pascua está muy lejos. 11 Es un destino exótico. Esconde extrañas leyendas y unas cabezas de piedra gigantescas..., y a veces extrañas leyendas sobre las cabezas gigantescas. Hay quien dice que los ancianos de la isla, con los hechizos adecuados, pueden despertar a las cabezas de piedra de su letargo y controlarlas como si fueran un ejército. Otros dicen que son las cabezas las que tienen el control sobre la energía vital, y que disfrutan del poder de robarla, lo que causaría una muerte a temprana edad, o bien de potenciarla, lo que confiere fuerza y virilidad a una minoría escogida. Y, entonces, a mediados de la década de 1960, un pequeño equipo de investigadores descubrió que esta última parte, la que habla de conferir fuerza y virilidad, quizá sea algo más que una simple leyenda.
Todo empezó cuando la pequeña y aislada comunidad que residía en la isla de Pascua decidió que ya había tenido bastante. Ya estaba harta de tanta pequeñez y tanto aislamiento. Y decidió que había llegado el momento de construir un aeropuerto.
Los científicos se volvieron locos. Una de las regiones más vírgenes del mundo estaba a punto de perder su pureza. Como solución de emergencia, un equipo internacional acudió a la isla para recoger muestras de su flora, fauna y distintos microorganismos, entre los que destacaban —y aquí viene la parte interesante de la historia— los extraídos de la tierra que había debajo de una de las misteriosas cabezas.
La tierra terminó en manos de un microbiólogo canadiense llamado Suren Sehgal, quien descubrió que la muestra, en realidad, tenía poderes mágicos... De la variedad antifúngica. Sehgal purificó el compuesto y le puso el nombre de «rapamicina» por el nombre original de la isla, Rapa Nui. 12 A pesar de que la investigación tenía un gran potencial, Sehgal se quedó sin presupuesto y el compuesto quedó olvidado hasta finales de la década de 1970, cuando reunió el dinero necesario para volver a su estudio. Fue entonces cuando descubrió que contenía más magia que tierra. La rapamicina no sólo era un antifúngico, sino que también actuaba como inmunosupresor, por lo que tenía un gran potencial en las operaciones de trasplante de órganos.
Aquel potencial se acabó convirtiendo en toda una industria. Desde entonces, la rapamicina se utiliza para casi todo, desde fabricar el revestimiento de los stents coronarios, 13 hasta evitar que los pacientes trasplantados rechacen su nuevo riñón. 14 Y, entonces, los investigadores hicieron un descubrimiento aún más increíble sobre aquella tierra mágica: la rapamicina inhibe el crecimiento de las células cancerígenas. 15
El compuesto bloquea una proteína que facilita la división celular. Si suministras el fármaco a lombrices, moscas y hongos, el resultado no se limita a sus propiedades anticancerígenas; la rapamicina incrementa la longevidad, lo que planteó una nueva pregunta: ¿la magia funcionaría también en mamíferos?
En 2009, los científicos de los NIH encontraron la respuesta y demostraron que la rapamicina alargaba la vida de los ratones en un 16 por ciento. 16 En 2014, la combinación de todos estos hallazgos llevó a Novartis a realizar un ensayo clínico en humanos, en lo que representaba el primer examen a gran escala de un compuesto antienvejecimiento por parte de una gran empresa farmacéutica. 17 Cuando los científicos descubrieron que aquella tierra era realmente mágica, la búsqueda de otros compuestos antienvejecimiento se puso en marcha.
La búsqueda condujo a muchos lugares, entre ellos al armario de los medicamentos que tenemos en casa, donde encontró un fármaco llamado metformina. 18 Se trata del medicamento más habitual contra la diabetes, que bloquea la producción de azúcar y ayuda a regular la insulina. Pero también ralentiza la «tasa de extinción» de las células, protege contra el estrés oxidativo, combate el cáncer y —como sabemos desde hace poco— alarga de forma significativa la esperanza de vida de lombrices, ratones y ratas. ¿Funciona en humanos? La pregunta aún no tiene respuesta, pero los investigadores están tratando de encontrarla.
Aunque la rapamicina y la metformina protegen contra los estragos de la edad, también hay otros científicos que están buscando nuevos compuestos que hagan retroceder el reloj. Con el nombre de «terapias senolíticas», estos fármacos destruyen las células zombis causantes de la inflamación, uno de los factores que supuestamente causan el envejecimiento. En la actualidad, hay media docena de empresas centradas en esta tarea, que ya están produciendo una docena de medicamentos que destruyen las células zombis, retrasando o paliando casi todos los males, desde la debilidad y la osteoporosis hasta los trastornos cardiacos y las enfermedades neurológicas.
Unity Biotechnology, que cuenta con el apoyo de inversores como Jeff Bezos, Peter Thiel y el desaparecido Paul Allen, es una de las más prometedoras. 19 Ha desarrollado un método para identificar y, después, eliminar las células senolíticas... Al menos en ratones. Pero funciona. Un tratamiento periódico a partir del momento en que el ratón alcanza la mediana edad alarga su esperanza de vida en un 35 por ciento y consigue además que tenga una mejor salud. 20 Todos los indicadores, desde los niveles bajos de energía hasta la aparición de cataratas o los problemas renales —síntomas habituales del envejecimiento—, desaparecen por completo o comienzan mucho más tarde. Con cerca de una docena de fármacos en desarrollo para tratar casi todas las enfermedades propias de la vejez, entre los que hay unos cuantos que ya han superado la Fase I de ensayos en humanos, Unity es una de las empresas que hay que tener en cuenta dentro del sector de la lucha contra el envejecimiento.
Por último, tenemos a Samumed, que quizá sea la empresa dedicada a la longevidad que está atrayendo más miradas. 21 Con el respaldo que representa tener una evaluación de 12.000 millones de dólares, 22 esta empresa de biotecnología de San Diego se centra en las vías de señalización Wnt, que, como su nombre sugiere, son uno de los sistemas que el cuerpo utiliza para enviar mensajes. 23 En este caso, esos mensajes gobiernan a un grupo de genes que contribuyen al crecimiento del feto y que, al mismo tiempo, parecen tener un importante papel en el envejecimiento. Los errores en las señales Wnt se han vinculado directamente a veinte enfermedades diferentes, incluyendo el cáncer. 24 Por este motivo casi todas las grandes empresas farmacéuticas llevan muchos años trabajando en estas señales. Sin embargo, parece que Samumed es la que ha descifrado el código secreto.
Ha focalizado sus esfuerzos en una vía Wnt en concreto, que regula el comportamiento de las células madre adultas. A través de esta metodología, Samumed ha desarrollado nueve fármacos diferentes que reciben el nombre de «medicamentos regenerativos». 25 Todos están ya en manos de la FDA, y los hay para todos los gustos, desde tratamientos para la alopecia hasta fármacos contra el mal de Alzheimer. Sin embargo, sus victorias contra la artritis y el cáncer son las que han atraído todas las miradas.
Empezaremos con la artritis, que afecta a 350 millones de personas en todo el mundo. 26 En la actualidad, la enfermedad no tiene cura. Pero, en 2017, Samumed publicó los resultados de un pequeño estudio sobre la osteoartritis de rodilla. 27 El ensayo incluía a sesenta y un pacientes, que recibieron una única inyección en la rodilla de un fármaco que reequilibra las Wnt. Los sesenta y uno experimentaron una notable mejoría. Cuando los investigadores comprobaron los efectos del medicamento seis meses después, descubrieron que los pacientes tenían menos dolor y más movilidad, además de dos milímetros de cartílago nuevo de promedio.
«La molécula permanece allí durante seis meses —explica el consejero delegado de Samumed, Osman Kibar—, durante los cuales estimula las células madre para que creen cartílago nuevo. 28 Y el nuevo cartílago es el de un adolescente. La clave es que las células madre progenitoras permanecen ahí incluso cuando tienes ochenta años, sólo hay que marcarlas de la manera adecuada.»
Y puede que esto sólo sea el principio.
«Una inyección de la misma molécula en la columna de una rata cuyo disco intervertebral ha sido destruido regenera un disco completamente nuevo —dice Kibar—. Si observas la calidad de las células, el disco es más joven y más fuerte.»
Pero conseguir que funcione en humanos en una historia muy distinta. Muy pocos medicamentos consiguen dar el salto de los ratones a los hombres (o a las mujeres), pero Samumed tiene otras moléculas, desarrolladas para reparar los traumas en el manguito de los rotadores y el talón de Aquiles, que ya han superado la Fase I de los ensayos, 29 mientras que su fármaco para la artritis de rodilla está a punto de entrar en la Fase III. 30 Aún queda mucho trabajo por hacer, pero el resultado podría ser un medicamento que ofrezca décadas de una sana movilidad.
Podría decirse que la rama más fascinante de las investigaciones de Samumed es su trabajo contra el cáncer, una enfermedad que podría describirse como un grupo de células madre que se han vuelto locas. Al silenciar la vía de señalización que conduce a semejante locura, los medicamentos de Samumed atacan —bastante literalmente— cualquier tipo de tumor. La mayoría de estos fármacos aún están en fase preclínica o en Fase I para probar su seguridad y eficacia. Sin embargo, gracias a las leyes que permiten conceder una autorización temporal en casos extremos, varios pacientes terminales han recibido los medicamentos de Samumed. Los resultados también han sido remarcables.
En una investigación muy limitada, un protocolo de tres tratamientos a dosis bajas detuvo el crecimiento tumoral en un 80 por ciento de los sujetos del grupo de estudio. 31 En otro estudio con pacientes con cáncer de páncreas, un protocolo más largo con este mismo compuesto consiguió mantener a raya la enfermedad, que suele ser mortal. «Con esta mujer todos los tratamientos habían fracasado —explica Kibar, hablando de la experiencia de uno de los pacientes—. Pesaba menos de 32 kilos y los médicos la habían enviado a casa (para morir). Pero hoy, después de un año tomando nuestro medicamento, ha vuelto a la normalidad. Se va de viaje, tiene citas, pesa 55 kilos, vive su vida de siempre. Está claro que aún estamos en una primera fase con este fármaco, pero, cuando menos, resulta un inicio prometedor.»
El sangriento manantial de la eterna juventud
A principios del siglo XXI , un grupo de investigadores de Stanford decidieron buscar la fuente de la eterna juventud en un lugar muy poco habitual: el mito de Drácula. 32 La leyenda, que se remonta a la Antigua Grecia, y que reaparece en la obra del poeta romano Ovidio y renace de nuevo en las historias góticas de vampiros, habla del efecto rejuvenecedor de la sangre joven. 33 Los investigadores de Stanford decidieron probar la teoría... en ratones.
En una especie de actualización de la antigua y espantosa técnica de la parabiosis, unieron el sistema circulatorio de un ratón joven al sistema circulatorio de otro viejo. Los resultados resultaban evidentes a simple vista. La sangre joven revivió al animal viejo.
Tras un análisis más detallado, los beneficios traspasaban los límites de lo visible. Una amplia variedad de los órganos y tejidos del ratón viejo tenían ahora las características de uno mucho más joven y sano. Los estudios posteriores confirmaron los resultados y descubrieron que lo contrario también era cierto. Una transfusión a animales jóvenes de la sangre de otros más viejos aceleraba el reloj, precipitaba la decrepitud y potenciaba el envejecimiento.
Este trabajo despertó muchísimo interés. En la década siguiente, los investigadores empezaron a descifrar los motivos de semejante transformación. Un equipo de Harvard se sumó a la investigación, y descubrió que la sangre joven activa la formación de nuevas neuronas en el cerebro y revierte el engrosamiento de las paredes del corazón. 34 , 35 Por último, y tras llegar a la raíz del problema, el equipo de Harvard descubrió una molécula en concreto, denominada «factor de diferenciación del crecimiento 11», o GDF11 por sus siglas en inglés, que parecía ser la responsable de todos, o como mínimo de una gran parte, de sus beneficios.
En un artículo publicado en 2014 en Cell , otro equipo distinto descubrió que una simple inyección de GDF11 en ratones mejoraba el flujo sanguíneo que llegaba al cerebro y aumentaba su fuerza y su memoria. 36 Otros estudios posteriores han ampliado la lista de sus beneficios y han demostrado que el GDF11 puede reducir los problemas cardiacos relacionados con la edad, acelerar la reparación del tejido muscular, mejorar la capacidad para hacer ejercicio y ampliar la función cerebral.
Todo este trabajo ha despertado el interés de las empresas. Por ejemplo, Elevian, una empresa nacida en Harvard que está dirigida por el doctor Mark Allen y un cuarteto formado por los profesores de biología regenerativa de la facultad, está buscando la longevidad en el GDF11 y otras moléculas similares que retrasan el envejecimiento. 37 , 38 Por su parte, Alkahest, que tiene su origen en Stanford, está buscando una especie de cóctel de plasma optimizado para tratar la enfermedad de Alzheimer. 39
Wired calificó este tipo de propuestas como «el enfoque de la aguja en el pajar», porque el plasma sanguíneo contiene más de diez mil proteínas diferentes. 40 En realidad, es como buscar una aguja en un filón de oro, porque identificar las proteínas que producen el efecto de la «sangre joven» ha provocado la aparición de una verdadera «fiebre del oro» biológica. Las emergentes tratan de seguir el rastro, por no mencionar las grandes empresas farmacéuticas. En 2017, el National Institute on Aging destinó 2,35 millones de dólares a aquellos científicos interesados en este trabajo. 41 Así que, ya ves, en el siglo XXI no sólo los coches voladores y los robots personales van a hacerse realidad, sino también la leyenda del mismísimo conde Drácula.
Durante miles de años hemos buscado el lugar donde se escondía la fuente de la eterna juventud. Pero lo que todos estos trabajos dejan claro es que, en realidad, no estábamos buscando un lugar, sino un momento. La fuente de la eterna juventud es un periodo concreto de la historia, el punto en el que las tecnologías convergen con la mortalidad. Así que, mientras la pregunta «¿podremos vivir eternamente?» permanece sin respuesta, convertir los cien años de edad en los nuevos sesenta —o sea, alargar de manera significativa la esperanza de vida— ha dejado de ser una mera posibilidad para convertirse en una cuestión que ya sólo tiene que ver con el «cuándo».
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

Meet Altos Labs, Silicon Valley’s latest wild bet on living forever
Funders of a deep-pocketed new "rejuvenation" startup are said to include Jeff Bezos and Yuri Milner.

Biological age reversal seems closer than it’s ever been
Scientists are making strides towards reprogramming cells to reverse their ageing and potentially cure age-related diseases, and investors are betting their millions on this field of biotechnology.

Former Google Exec Warns That AI Researchers Are "Creating God"
Mo Gawdat believes that the singularity is inevitable.
CRISPR Technique Effectively Destroys Metastatic Cancer Cells in Living Animal
Harnessing CRISPR-Cas9 technology for cancer therapeutics has been hampered by low editing efficiency in tumors and potential toxicity of existing delivery systems. Scientists at Tel Aviv University describe a safe and efficient lipid nanoparticle (LNP) for the delivery of Cas9 mRNA and sgRNAs...
DNyuz - Latest Breaking U.S. News
Latest Breaking News, U.S. and World Politics, Crime, Business, Science, Technology, Autos, Entertainment, Culture, Movie, Music, Sports.
dnyuz.com
Science | AAAS
Science | AAAS
Modifying One Gene Allows Mice to Live 23% Longer
By modifying just one gene, researchers were able to extend the life expectancy of mice by 23%, and they think their results may translate to humans.
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

Bayer backs a George Church spinout trying to turn lab-invented amino acids into a new class of protein therapies
Six years ago, Daniel Mandell appeared on NPR to talk about an invention out of Jurassic Park. As Crichton and Goldblum fans recall, International Genetic Technologies ...

‘Yeah, we’re spooked’: AI starting to have big real-world impact, says expert
Prof Stuart Russell says field of artificial intelligence needs to grow up quickly to ensure humans remain in control
Team builds first living robots—that can reproduce
By Joshua Brown, University of Vermont Communications (BURLINGTON, Vermont) – To persist, life must reproduce. Over billions of years, organisms have evolved many ways of replicating, from budding plants to sexual animals to invading viruses. Now scientists at the University of Vermont, Tufts...

A Cure for Type 1 Diabetes? For One Man, It Seems to Have Worked.
Brian Shelton’s life was ruled by Type 1 diabetes. When his blood sugar plummeted, he would lose consciousness without warning. He crashed his motorcycle into a wall. He passed out in a customer’s yard while delivering mail. Following that episode, his supervisor told him to retire, after a...

Hackney man first to receive 3D-printed prosthetic eye
Steve Verze will be given the realistic eye at Moorfields Eye Hospital in London.

The Singularity: When will we all become super-humans?
Are we really only a moment away from "The Singularity," a technological event that will usher in a new era in human evolution?
Paralysed mice walk again after a single injection | BBC Science Focus Magazine
The therapy, which the researchers hope to trial in humans, harnesses ‘dancing molecules’ to communicate with the body’s cells.
www.sciencefocus.com

Cinco posibles alternativas del silicio para los transistores
Se han propuesto muchos sucesores a lo largo de los años, con materiales como el dióxido de titanio o el carbono.
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

New 'Anti-Aging' Vaccine Has Increased Mouse Life Spans. Would It Work in Humans?
An experimental vaccine successfully eliminated aging cells from the bodies of mice, helping to prolong the rodents' lives and reverse some signs of age-related disease.

Elon Musk Says That Immortality Tech Would Be Very Dangerous
During an interview this week, Elon Musk warned that letting people live longer lives by coming up with new technologies may actually be a really bad idea.
Paralyzed man with brain chip posts ‘first direct-thought’ tweet
A company that implants neural computer interfaces into the brain says a patient with a nervous system disease that left him motionless was able to share a post on social media by just thinking it.

First in Israel: Mastectomy performed completely by 'hands' of a robot | The Jerusalem Post
A robot-assisted surgery was completed in Israel using the Da Vinci surgical system, by which the surgeon sits at a console and controls the robot.
- Mensajes
- 2.016.669
- Reacciones
- 2.007.849

“Tener un sensor en la cabeza será de rigor en 10 años, igual que ahora todo el mundo tiene un teléfono inteligente”
El neurocientífico Rafael Yuste y el ingeniero Darío Gil alertan en la Casa Blanca de la inminente llegada de dispositivos que conectarán el cerebro directamente con internet
Dandreemex
Tabernario
- Mensajes
- 9.430
- Reacciones
- 8.289
- Mensajes
- 2.016.669
- Reacciones
- 2.007.849
Estamos preparando ya Skynet, dentro de poco podremos subir nuestras conciencias como en Ready Player One

 elpais.com
elpais.com

Meta ultima un superordenador para impulsar el metaverso de Mark Zuckerberg
La compañía inaugurará a mediados de año un centro de cálculo diseñado para entrenar modelos avanzados de inteligencia artificial, como el necesario para traducir en tiempo real lo que digan personas en distintos idiomas
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

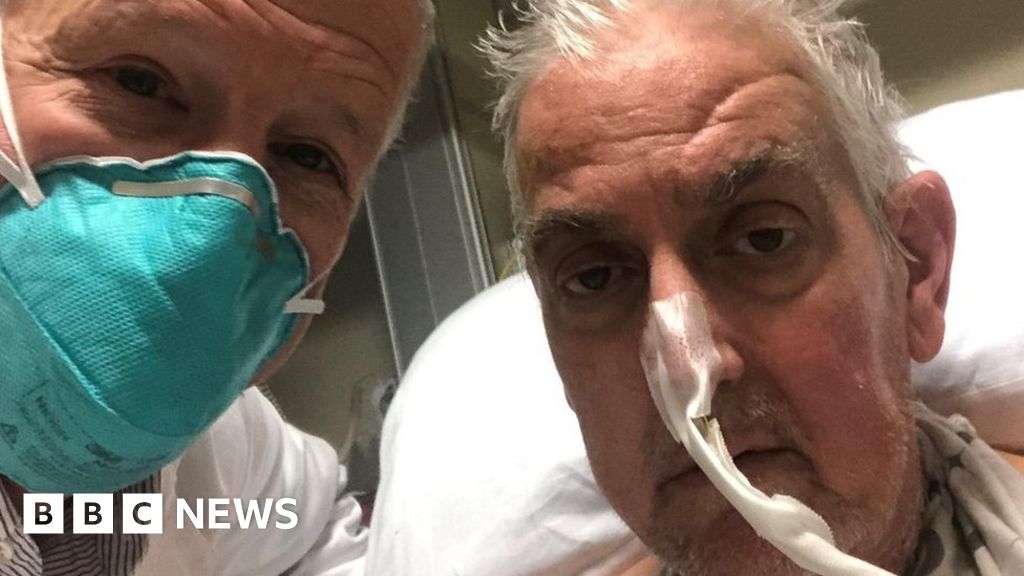
Man gets genetically-modified pig heart in world-first transplant
David Bennett, 57, is doing well three days after the experimental surgery, doctors say.

"Young blood" particles that help old mice fight aging identified
It sounds like gothic horror, but studies have shown that giving elderly mice transfusions of blood plasma from younger mice can rejuvenate their cells, reversing some of the effects of aging. In a new study, researchers from the University of Pittsburgh have identified a specific component of…

World's oldest person celebrates 119th birthday
Kane Tanaka at 119 has lived during the Meiji, Taisho, Showa, Heisei and current Reiwa eras

Kernel Flow: A wearable device for noninvasive optical brain imaging
Recent advances in brain imaging techniques facilitate accurate, high-resolution observations of the brain and its functions. For example, functional near-infrared spectroscopy (fNIRS) is a widely used noninvasive imaging technique that employs near-infrared light (wavelength >700 nm) to...
Physicists Discover a New Photonic Effect That Could Accelerate the Discovery of Life-Saving Medicines
Keeping up with the first law of robotics: a new photonic effect for accelerated drug discovery. A new photonic discovery in semiconducting nanohelices could revolutionize drug discovery by enabling the measurement of chirality in minute volumes, thus speeding up the development of critical pharm
scitechdaily.com

Scientists develop ‘electronic skin’
Chinese scientists have unveiled ‘electronic skin’ that enables tactile feedback, allowing a human operator to control a robot remotely.
Rejuvenation by controlled reprogramming is the latest gambit in anti-aging
Startups are betting that partial reprogramming with Yamanaka factors may lead to age reversal, but hurdles remain.

NVIDIA GPUs Enable Simulation of a Living Cell
Researchers from the University of Illinois developed GPU-accelerated software to simulate a cell that metabolizes and grows like a living cell.
blogs.nvidia.com

Realizing Gene Therapy and Cell Regeneration in Heart Disease
After decades of treating the big categories of heart disease – hypertension, for example – the ability to address the genetics of heart disease is within sight.

Gut bacterial metabolite could improve muscle endurance in aging
A study explores how supplementing with a compound produced by gut bacteria when digesting foods such as pomegranates could help reverse muscle aging.
 www.medicalnewstoday.com
www.medicalnewstoday.com

Scientists were able to regrow frog legs. Will it pave the way for regeneration in people?
Scientists say they have been able to help frogs regrow their legs using a five-drug-cocktail silicone cap. The next step? Trying it on mammals.

Jeff Bezos Is Paying for a Way to Make Humans Immortal
He's backing a new biotech company working on "cellular rejuvenation programming."
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459



What if women never had to give birth again?
The idea of human ectogenesis has always been seen as science fiction, but it may not be for much longer.

Pig heart transplant patient: 5 weeks after surgery, heart shows 'no signs of rejection'
Pig heart transplant recipient David Bennett was able to sit up, watch the Super Bowl from his hospital room at University of Maryland Medical Center.

Celebrating record-breaking runner Julia 'The Hurricane' Hawkins' 106th birthday
Julia Hawkins started sprinting at age 100 and shows no sign of slowing down.

Coffee can help you live longer, a decade-long study concludes
The decade-long study surveyed half a million people

Paralysed man with severed spine walks thanks to implant
Michel Roccati tells the BBC he "almost has a normal life" again thanks to an electrical implant.
Elon Musk's Neuralink Is an Absolute Disaster, Former Employees Say
Top-Down Dissatisfaction Trouble is still brewing at Neuralink. Despite co-founder Elon Musk’s insistence that the brain-computer interface startup will be headed to human trials later this year, many experts aren’t so sure. Now, several former employees have spoken to Fortune about just how...

Elon Musk’s brain chip firm Neuralink lines up clinical trials in humans
Implants that Musk says could allow paralysed people to walk already tested on a macaque and a pig

This Technology Will Help People Drastically Extend Their Lifespan by 500 Years and Beyond
Futurist Dr. Ian Pearson believes that if you live to 2050, you may never die. Here is why.

‘I’m really just high on life and beauty’: the woman who can see 100 million colours
As a kid, Concetta Antico was always ‘a bit out of the box’, but it took decades for her to discover just how differently she was seeing the world

Un equipo liderado por Juan Carlos Izpisúa logra rejuvenecer ratones
Un equipo de investigadores liderado por el científico español Juan Carlos Izpisúa logra revertir los efectos del envejecimiento en ratones de forma segura y eficaz.
No sé si viste este vídeo que puse hace un par de meses. Habla de otro estudio similar en ratones, también modificando los factores de transcripción de Yamanaka, y profundiza más que el artículo. Y el vídeo es de 2019.
Un equipo liderado por Juan Carlos Izpisúa logra rejuvenecer ratones
Un equipo de investigadores liderado por el científico español Juan Carlos Izpisúa logra revertir los efectos del envejecimiento en ratones de forma segura y eficaz.www.lavanguardia.com
No sé si se habrá puesto ya. Interesante, increíble.
Mi gran duda es si con estos procesos rejuveneces una parte del cuerpo o *todo* el cuerpo, y con eso quiero decir *todas las células del cuerpo*. Es decir, si también estas rejuveneciendo (físicamente, me refiero) el cerebro y sus células. Entiendo que en ratones no tiene importancia, o por lo menos no a simple vista, habría que preguntarle al ratón, pero un cambio (rejuvenecimiento) en el cerebro imagino que implicaría un cambio en la personalidad, recuerdos... No lo sé, habría que ver cómo se almacena toda esa información en el cerebro y si se vería afectada, que imagino que sí.
Un gran tema en cualquier caso. El futuro va a ser muy loco.

No lo había visto porque de hecho no había entrado en este hilo hasta ahora.
Un tema interesante, eso sí.
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459
Esto ya si que es la pera."Arqueologia cuantica" la tecnología ultraradical con la que ya están especulando algunos con la que se podría resucitar a todos los humanos que hayan existido jamás a lo largo de toda la historia. Seria genial tener de vuelta a Isaac Newton,Asimov o Socrates entre otros muchos ejemplos ¿No creéis? Y por supuesto a todos nuestros seres queridos.  Podriamos incluso conocer a nuestros antepasados lejanos sin los cuales no estaríamos aquí.
Podriamos incluso conocer a nuestros antepasados lejanos sin los cuales no estaríamos aquí.
Pero lo mejor seria que ya no nos tendríamos que preocupar por la muerte por que aunque la tecnología antienvejecimiento no nos alcanzase e incluso aunque no nos criopreservasemos daría igual puesto que acabaríamos siendo traídos de vuelta a la vida mas tarde o mas temprano.

 www.newsweek.com
www.newsweek.com
Y unos cuantos artículos mas:

 finance.yahoo.com
finance.yahoo.com

 alsnewstoday.com
alsnewstoday.com

 www.fiercebiotech.com
www.fiercebiotech.com

 bigthink.com
bigthink.com
 www.medicalnewstoday.com
www.medicalnewstoday.com

 www.longevity.technology
www.longevity.technology

 www.drugtargetreview.com
www.drugtargetreview.com
 Podriamos incluso conocer a nuestros antepasados lejanos sin los cuales no estaríamos aquí.
Podriamos incluso conocer a nuestros antepasados lejanos sin los cuales no estaríamos aquí.Pero lo mejor seria que ya no nos tendríamos que preocupar por la muerte por que aunque la tecnología antienvejecimiento no nos alcanzase e incluso aunque no nos criopreservasemos daría igual puesto que acabaríamos siendo traídos de vuelta a la vida mas tarde o mas temprano.


The Quest to 3D-Bioprint Every Dead Person Back to Life
Can radical scientific and technological advances really solve the problem of death?
Y unos cuantos artículos mas:

‘I want a beer’: Paralysed man communicates first words in months using brain implant
Locked-in ALS patient also asked to listen to Tool ‘loud’ and ordered a curry

Brain Implant Allows Man Paralyzed by ALS to 'Speak' Again
A brain implant has enabled a fully "locked-in" ALS patient to express care wishes and tell his 4-year-old son he loves him.

Exclusive: How far are we from lab-grown organs? This Y Combinator startup is printing a road map
Thirty years ago, when the field of tissue engineering beginning to coalesce, experts predicted we were just | Thirty years ago, experts predicted we were just a couple of decades away from creating brand-new organs for patients. So why aren’t we, in 2020, growing replacement lungs, livers and...

Injectable gel repairs severe spinal cord injuries and enables mice to walk
An injectable gel helped mice with spinal cord injuries walk. The scientists are headed "straight to the FDA" to begin human trials.

Anti-aging supplement works in mice, maybe humans
A study from Baylor College of Medicine finds that a supplement can slow or correct various aspects of natural aging in mice, potentially extending human life.
 www.medicalnewstoday.com
www.medicalnewstoday.com

Is gene therapy ready to take flight?
Telocyte founder Michael Fossel compares the gene therapy field to aviation five years after the Wright brothers’ first flight.
 www.longevity.technology
www.longevity.technology

Gene therapy method could restore visual function after stroke
Scientists reveal a way to use gene therapy to turn glial brain cells into neurons, restoring vision and potentially restoring motor function.
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459
Skin cells made 30 years younger with new 'rejuvenation' technique
Never before have cells been de-aged by so many years and still retained their specific type and function.
Programme of self-reactive innate-like T cell-mediated cancer immunity - Nature
A survey of T cell populations in human and mouse tumours identifies a population of cancer-sensing IL-15-activated αβ T cell receptor-positive FCER1G-expressing innate-like T cells with high cytotoxic potential.

California start-up sends tiny robots on voyage into brains
Sending miniature robots deep inside the human skull to treat brain disorders has long been the stuff of science fiction—but it could soon become reality, according to a California start-up.
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

First Patient Injected With Experimental Cancer-Killing Virus in New Clinical Trial
An experimental cancer-killing virus has been administered to a human patient for the first time, with hopes the testing will ultimately reveal evidence of a new means of successfully fighting cancer tumors in people's bodies.

/cloudfront-eu-central-1.images.arcpublishing.com/prisa/LCXRWNBJEZDTZNOQSMLKNQW4E4.jpg)
Why living up to the age of 130 is a ‘reasonable’ proposition
Spanish scientist Corina Amor talks to EL PAÍS about her revolutionary experimental treatment to destroy the cells responsible for aging and cancer

Can Brain Death Be Reversed? Some Researchers Are Hopeful
The lights do not go out all at once at death and interventions that were not possible in 1968 (Harvard definition of brain death) may become possible today.
 mindmatters.ai
mindmatters.ai
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459
Spermidine 101: Everything You Need to Know
Spermidine is taking the longevity community by storm! This simple and safe supplement has been shown to significantly increase lifespan in a wide range of animals, including humans.
Every Single Patient in This Small Experimental Drug Trial Saw Their Cancer Disappear
In what appears to be a very promising breakthrough for the treatment of rectal cancer, a small drug trial conducted in the US found every patient treated in the experiment had their cancer successfully go into remission.
'Masked' Cancer Drug Kills Tumors While Sparing Healthy Tissue, Early Results Show
Many cancer treatments are notoriously savage on the body. Drugs often attack both healthy cells and tumor cells, causing a plethora of side effects.

The 'Benjamin Button' effect: Scientists can reverse aging in mice. The goal is to do the same for humans
Scientists around the world are scurrying to reverse the hands of time. Here's a look at one lab's search for the fountain of youth, where old mice have grown young again.
Saudi Arabia Pledges $1 Billion a Year to Anti-Aging Research
The Saudi royal family, led by king Salman bin Abdulaziz have announced the formation of a non-profit research foundation which intends to spend $1 billion of the countries considerable annual oil revenue on supporting anti-aging research. If such funding materialises, it will make Saudi Arabia...

Google engineer put on leave after saying AI chatbot has become sentient
Blake Lemoine says system has perception of, and ability to express thoughts and feelings equivalent to a human child

Google AI Claims to Be Sentient in Leaked Transcripts, But Not Everybody Agrees
A senior software engineer at Google was suspended on Monday (June 13) after sharing transcripts of a conversation with an artificial intelligence (AI) that he claimed to be "sentient", according to media reports. The engineer, 41-year-old Blake Le

Why you may have a thinking digital twin within a decade
Within 10 years people may be able to have a intelligent online version of themselves.
www.bbc.com

Whole human genome sequencing for $100
Ultima Genomics, a biotech company based in California, has emerged from stealth mode with a new high-throughput, low-cost sequencing platform that it claims can deliver a $100 genome.

Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

La generación de fármacos milagrosos que podría extender la esperanza de vida humana a los 200 años - Longenia
Un nuevo típico de medicamento milagroso podría extender la esperanza de vida humana hasta los 200 años, según detalla en su último libro sobre longevidad el biólogo computacional británico Andrew Steele. El campo de estudio es el de los senolíticos, medicamentos capaces de eliminar las células...
 www.longenia.org
www.longenia.org

‘The Game is Over’: Google’s DeepMind says it is on verge of achieving human-level AI
New Gato AI is ‘generalist agent’ that can carry out a huge range of complex tasks, from stacking blocks to writing poetry

Us Army to Begin Testing Anti-Ageing Medication
The United states army are planning to test NAD+ dietary supplementation experiments next year in hopes of producing a viable method of increasing the viable length of a soldier's active service.

Two decades of Alzheimer’s research was based on deliberate fraud by 2 scientists that has cost billions of dollars and mi
Last month, drug company Genentech reported on the first clinical trials of the drug crenezumab, a drug targeting amyloid proteins that form
 wallstreetpro.com
wallstreetpro.com

Pig organs partially revived in dead animals — researchers are stunned
Scientists warn that the findings aren’t yet clinically relevant but say the research raises ethical questions about the definition of death.
AI is learning how to create itself
Humans have struggled to make truly intelligent machines. Maybe we need to let them get on with it themselves.
Researchers Say They’ve Reversed Ageing in Human Cells by 30 Years
Researchers have reversed ageing in human skin cells by 30 years, according to a new study.

Cornea made from pig collagen gives people who were blind 20/20 vision
Twenty people who were legally blind or visually impaired received a transplant of a cornea made from pig collagen. All of them had improved sight, including three who now have 20/20 vision after being legally blind

How AI is reinventing what computers are
Three key ways artificial intelligence is changing what it means to compute.
:extract_focal()/https%3A%2F%2Fhips.hearstapps.com%2Fhmg-prod.s3.amazonaws.com%2Fimages%2Ftriathlete-doing-cycling-stage-royalty-free-image-978132608-1546631644.jpg%3Fcrop%3D1.00xw%3A0.850xh%3B0%2C0.150xh%26resize%3D480%3A*)
Here’s How Much to Ride a Week to Keep Your Brain 9 Years Younger
Combine your regular rides with a healthy diet, and get ready to reap the mind-boosting benefits.

The 5 Best Exercises To Lose Belly Fat and Slow Aging, Says Fitness Expert — Eat This Not That
Ready to kill two birds with one stone? We've put together some pretty stellar exercises that'll help you lose belly fat and slow aging.

What Science Says About the Exercise Habits That Slow Aging — Eat This Not That
Want to make your body and brain 10 years younger? We're here to share everything science says about the exercise habits that slow aging.
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

A Doubled Gene Explains the Bowhead Whale’s Lifespan
A preprint published in bioRxiv has partially explained the lifespan of the bowhead whale through its duplication of CDKN2C, which regulates how cells divide. Peto’s paradox It would be logical for […]

Can we find ways to live beyond 100? Millionaires are betting on it.
At a luxury resort in the Swiss Alps, wealthy investors and scientists are cooking up plans to push the limits of the human lifespan.
Experts predict that we'll be able to live up to 20% longer over the next 100 years. Here's how humans are trying to live forever.
Death has no cure, but thanks to scientific breakthroughs, from anti-aging drugs to cryonics, we're closer than ever to finding one.

How scientists want to make you young again
Research labs are pursuing technology to “reprogram” aging bodies back to youth.

AI is learning how to create itself
Humans have struggled to make truly intelligent machines. Maybe we need to let them get on with it themselves.
Pereirano
Miembro habitual
- Mensajes
- 9.218
- Reacciones
- 3.459

Anti-ageing scientists extend lifespan of oldest living lab rat
Research teases hopes that ‘rejuvenation of the body may become commonplace within our lifetimes’

Sam Altman invested $180 million into a company trying to delay death
Can anti-aging breakthroughs add 10 healthy years to the human life span? The CEO of OpenAI is paying to find out.

Feasibility of mapping the human brain with expansion x-ray microscopy
By Logan Thrasher Collins Click here for PDF version Combining synchrotron x-ray microscopy with expansion microscopy may represent a feasible approach for whole human brain connectomics at the nan…
 logancollinsblog.com
logancollinsblog.com

Loss of Epigenetic Information Can Drive Aging, Restoration Can Reverse It
Study implicates changes to way DNA is organized, regulated rather than changes to genetic code

Humans' big-brain genes may have come from 'junk DNA'
"De novo" genes may have paved the way for humans' big brains.

Neuralink Cofounder Says New Company's Eye Implant Could Be "Ultimate" VR Tech
After leaving Neuralink in 2021, Max Hodak is back with a brain-computer interface startup of his own — and his plans are pretty next-level.
Alzheimer’s Mystery Solved: “Angry” Immune Cells in Brain and Spinal Fluid Identified As Culprit
Immune cells in brain and spinal fluid become dysregulated and ‘a little angry’ as we age. Cerebrospinal fluid immune system is drastically altered in individuals with cognitive impairment Discovery could potentially be used to treat inflammation of the brain First thorough analysis of i
scitechdaily.com

This is your brain. This is your brain on code
Researchers from MIT's Computer Science and Artificial Intelligence Laboratory (CSAIL) found that the Multiple Demand and Language brain systems encode specific code properties and uniquely align with machine-learned representations of code.



