Install the app
How to install the app on iOS
Follow along with the video below to see how to install our site as a web app on your home screen.
Se debe tener en cuenta: This feature may not be available in some browsers.
Estás usando un navegador obsoleto. No se pueden mostrar este u otros sitios web correctamente.
Se debe actualizar o usar un navegador alternativo.
Se debe actualizar o usar un navegador alternativo.
El post de las enfermedades infecciosas
Edgtho
Miembro habitual
Evidence based!!! 100cia forever!!
Esperemos. Hace tanto tiempo que no veía el coche, que aprovechando que mi WAT ha salido a dar un paseo caminando le he pedido que fuera a verlo para comprobar que aún seguía allí, y de paso que me enviara una foto para ver el aspecto que presentaba.Tranquilo, que vas a pasar
Manu1001
Au revoire.
- Mensajes
- 78.709
- Reacciones
- 21.735
Actualizo no por mí, sino porque veáis como está funcionando esto. Mucho confinamiento, mucha mascarilla, muchas medidas estúpidas, peeero... me diagnostican positivo hace dos semanas y media... por teléfono. Tardan dos semanas en hacerme el puto test conviviendo con personas de riesgo (mi mujer es asmática). El seguimiento diario telefónico se transforma en dos llamadas en todo este tiempo. Y hoy, cuatro días ya desde que me hicieron la prueba, nadie sabe dónde están mis resultados. Y a mi familia se niegan a hacerles test.
Estoy muy, pero que muy quemado. Que recen por que mi mujer no caiga enferma (ya tiene síntomas), porque me agencio una recortada y no respondo. Me cago en todo ya...
Estoy muy, pero que muy quemado. Que recen por que mi mujer no caiga enferma (ya tiene síntomas), porque me agencio una recortada y no respondo. Me cago en todo ya...

"Dadle caña que Twitter tardará ná y menos en borrarlo."
Sí, ya, porque Twitter es una red social conocidísima por censurar los discursos de izquierdas.
De verdad, esta gente vive en un universo paralelo.
Sí, ya, porque Twitter es una red social conocidísima por censurar los discursos de izquierdas.
De verdad, esta gente vive en un universo paralelo.

Mascarillas: todo lo que debes saber sobre su uso, desinfección y cómo guardarlas
Te exponemos una breve guía sobre la utilización de mascarillas, que desde hoy jueves es obligatorio en toda España llevarlas puestas, salvo excepciones

Pik
Miembro habitual
Ojo, que con 5 días de retraso han publicado lo de las condiciones para eliminar franjas horarias en pueblos de menos de 10.000 habitantes y... además de tener menos de 10.000 habitantes no se puede tener una densidad superior a 100 habitantes por kilómetro cuadrado.
Conclusión, ningún pueblo de todo Euskadi con menos de 10.000 hbaitantes cumple la norma. Ninguno, cero.
Y me imagino que la gran mayoría de otras regiones tampoco. Es una densidad muy baja.
Conclusión, ningún pueblo de todo Euskadi con menos de 10.000 hbaitantes cumple la norma. Ninguno, cero.
Y me imagino que la gran mayoría de otras regiones tampoco. Es una densidad muy baja.
Edgtho
Miembro habitual
Pero luego que si Madrid fase 0 porque patatas. La gente ni pudiendo bañarse en Canarias que te baja el helicóptero un multazo del quince, pero Barcelona en fase 0 hacemos los que nos sale la punta, además de vender "responsabilidad". Pues vale. Si algo está demostrando esto de las fases es que hay ciudadanos de primera y de segunda.
Pik
Miembro habitual
En UK tambien cuarentena de 14 días para extranjeros.
Me jode mucho, pero debería haber consecuencias. O empieza a multar o que nos sigan dejando en fase 0.Pero luego que si Madrid fase 0 porque patatas. La gente ni pudiendo bañarse en Canarias que te baja el helicóptero un multazo del quince, pero Barcelona en fase 0 hacemos los que nos sale la punta, además de vender "responsabilidad".
Jesse Custer
Miembro habitual
Pues sí, porque la gente se hace la tonta directamente...
Manu1001
Au revoire.
- Mensajes
- 78.709
- Reacciones
- 21.735
Un conocido, ayer. Lleva a la niña a la playa. Ella, loca de alegría, mete los pies en el agua pegando saltos. Su padre la riñe y le dice que salga. Un municipal le dice que no sea malaje, que la deje bañarse que el no ha visto nada. Y sigue caminando su ronda. Oh, yeah.
Jesse Custer
Miembro habitual
Como los virus tampoco se ven....
Por aqui el uso supuestamente obligatorio anda 60% que las usan y 40% que no.Preferiria no llevarla y que la norma siguiera siendo que solo fuera recomendable en exteriores,aunque veo que la gente la lleve o no le cuesta mantener la distancia cuando pasan a tu lado.Asi que la obligatoriedad en exteriores espero que no se alargue mucho porque,no se como andara el clima por vuestras zonas,aqui al lado del mar con la humedad que hay no hace falta que la temperatura suba mucho para que la puñetera mascarilla resulte inaguantable.Hoy con poco mas de 20º y transitando por la sombra se toleraba,pero en cuanto empecemos a subir de los 25º y mas con una humedad alta esto puede ser la muerte.
KLopeK
Rey del forochateo. De absoluta y rigurosa moda
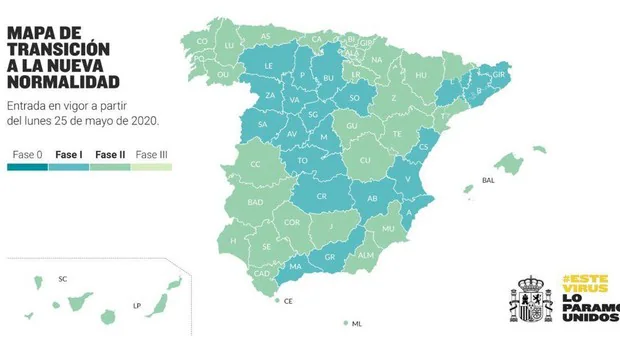
El ministro de Sanidad, Salvador Illa, ha anunciado esta mañana cuáles son los territorios que avanzarán de fase el próximo lunes. Madrid, el área metropolitana norte y sur de Barcelona y todas las provincias de Castilla y León, que hasta ahora se mantenían en la fase 0, dan un paso hacia delante en la desescalada y pasan a fase 1.
Entre las que pasan a la fase dos están Asturias, Aragón, los territorios de las islas Baleares que se encontraban en fase 1 (Ibiza Menorca y Mallorca), las islas de Canarias que aún no habían pasado a la fase 2 (Tenerife, Gran Canaria, Lanzarote, Fuerteventura y La Palma), Cantabria, Extremadura, Galicia, Murcia, Navarra, País Vasco, La Rioja, Ceuta y Melilla. En Cataluña avanzan hasta esta fase las zonas sanitarias de Campo de Tarragona, Alto Pirineo y Arán y las Tierras del Ebro. En Andalucía, todas las provincias excepto Málaga, Granada, y de Castilla-La Mancha pasan Guadalajara y Cuenca.
La Comunidad Valenciana se mantiene en la fase 1, algo que ya se sabía tras la decisión de las autoridades autonómicas de no solicitar su avance a la fase 2. Según ha asegurado el ministro de Sanidad, ha sido la única comunidad que no ha solicitado avanzar de fase en la desescalada.
KLopeK
Rey del forochateo. De absoluta y rigurosa moda
:format(jpg):quality(99):watermark(f.elconfidencial.com/file/bae/eea/fde/baeeeafde1b3229287b0c008f7602058.png,0,275,1)/f.elconfidencial.com/original/991/31f/b8a/99131fb8ab4e093e5f2f4f9e8f734c41.jpg)
Las mascarillas reducen los contagios de covid-19 un 50% si las llevan los infectados
La Universidad de Hong Kong ha realizado unas pruebas en laboratorio con hámsters en las que se confirma que la mascarilla es muy efectiva, especialmente en los contagiados
>La Universidad de Hong Kong ha realizado unas pruebas en laboratorio con hámsters en las que se confirma que la mascarilla es muy efectiva, especialmente en los contagiados.
El departamento de microbiología de la Universidad de Hong Kong decidió llevar a cabo un estudio con hámsters para estudiar cómo se transmitía el coronavirus. Para ello, utilizó dos jaulas diferentes separadas por unos metros, donde una contaba con animales infectados con covid-19 y la otra con animales sanos. A su lado, un ventilador entre jaulas que permitía la transmisión de partículas entre ellos. A través del uso de mascarillas, generaron tres escenarios diferentes.
En primer lugar, hicieron el experimento con las dos jaulas libres de mascarillas y los resultados obtenidos una semana después eran evidentes: el 66,7% de los hámsters sanos se habían infectado de covid-19. En segundo lugar, se colocó la mascarilla a los hámsters sanos, lo que redujo el contagio al 33%. Por último, la mascarilla fue utilizada simplemente sobre los animales infectados: solo un 16,7% de los hámsters sanos se enfermaron.
O, dicho de otra manera, los expertos de la Universidad de Hong Kong descubrieron que la tasa de transmisión del coronavirus a través de gotas respiratorias o partículas en el aire disminuía hasta un 75% cuando los animales utilizaron mascarillas en las pruebas de laboratorio. Pero, además, descubrieron que los hámsters que se habían contagiado a pesar de llevar mascarilla tenían una cantidad residual de virus en comparación con los animales infectados que no llevan esta protección.
"En nuestro experimento, se muestra muy claramente que si los hámsters o humanos infectados, especialmente los asintomáticos o sintomáticos, se ponen mascarillas, en realidad lo que están haciendo es proteger a otras personas. Ese es el resultado más contundente que mostramos aquí", afirma Yuen Kwok-yung, principal responsable del estudio a 'CNBC'. "La transmisión se puede reducir hasta un 50% cuando se usan mascarillas, especialmente si las utilizan los infectados", explica.
Los expertos de Hong Kong explicaron que utilizaron hámsters porque tienen receptores enzimáticos muy similares a los del ser humano, por lo que se considera que los resultados obtenidos en estos animales son los más aproximados posible a nuestra realidad. De momento, no es más que un simple estudio de laboratorio, pero a falta de una vacuna, cualquier medida de protección siempre parece poca y todo apunta a que la mascarilla es mucho más efectiva de lo que se pueda creer.
KLopeK
Rey del forochateo. De absoluta y rigurosa moda
Más periodo de incubación pero menos casos graves??
> El consejero de sanidad de la Comunidad de Madrid: "los responsables de medicina interna y urgencias nos dicen que los casos que llegan ahora son casos más leves que los de marzo y abril"

 www.elmundo.es
www.elmundo.es
> El consejero de sanidad de la Comunidad de Madrid: "los responsables de medicina interna y urgencias nos dicen que los casos que llegan ahora son casos más leves que los de marzo y abril"

El coronavirus muestra un comportamiento diferente al de Hubei en el noreste de China
Los casos del último rebrote del coronavirus en China, registrados en el noreste del país, tienen diferentes características a los del brote original, que surgió de la provincia ce
KLopeK
Rey del forochateo. De absoluta y rigurosa moda

Cuarentena en un crucero con 400 pasajeros en Barcelona tras un caso de coronavirus a bordo
El Ministerio de Sanidad ha informado hoy de que un crucero con 400 pasajeros de diversas nacionalidades se encuentra en cuarentena en el puerto de Barcelona tras ser detectado un
Edgtho
Miembro habitual
Hablando de mascarillas, a esta gente le da ya igual todo, van a calzón sacado.
Pues eso,que tenemos mas fases que un videojuego y para crear mas confusion decidieron que era buena idea incluir los DLC con aun mas fases.
Y dos meses despues,al parecer,han tenido una revelacion con las mascarillas y las ponen obligatorias dependiendo de la interpretacion.
Esperemos que esas informaciones y teorias de que el virus se esta "debilitando" o que el calor pueda dejarlo fuera de juego sean ciertas.O como otra que dice que este virus podria desaparecer tan repentinamente como aparecio pueda ser verdad,porque viendo como se estan llevando las cosas como sigamos confiando en la suerte como unica medida lo llevamos claro.
Y dos meses despues,al parecer,han tenido una revelacion con las mascarillas y las ponen obligatorias dependiendo de la interpretacion.
Esperemos que esas informaciones y teorias de que el virus se esta "debilitando" o que el calor pueda dejarlo fuera de juego sean ciertas.O como otra que dice que este virus podria desaparecer tan repentinamente como aparecio pueda ser verdad,porque viendo como se estan llevando las cosas como sigamos confiando en la suerte como unica medida lo llevamos claro.
El calor de Brasil se ve que mucho no le afecta al virus....Esperemos que esas informaciones y teorias de que el virus se esta "debilitando" o que el calor pueda dejarlo fuera de juego sean ciertas.
KLopeK
Rey del forochateo. De absoluta y rigurosa moda
Continúa el lio cifras. En manos de quien estamos? de GENTUZA.
Simón, sobre Cataluña: "Nos han sorprendidos los datos de ayer tarde y de esta mañana de Cataluña. Los datos para pasar de fase fueron presentados el lunes, por eso se ha aprobado el cambio de fase. La valoración se hizo en base a lo que entregó el lunes y las dudas, con algún esfuerzo, fueron resueltas. Lo de ayer pensamos que era puntual, pero hoy nos ha preocupado. No es tema baladí el no saber los datos de Cataluña.
Estos dos últimos días, está teniendo que validar la información, que llega con cifras que requieren alguna matización porque tienen alguna incongruencia. Está teniendo problemas con la validación de estos datos.!
Simón, sobre Cataluña: "Nos han sorprendidos los datos de ayer tarde y de esta mañana de Cataluña. Los datos para pasar de fase fueron presentados el lunes, por eso se ha aprobado el cambio de fase. La valoración se hizo en base a lo que entregó el lunes y las dudas, con algún esfuerzo, fueron resueltas. Lo de ayer pensamos que era puntual, pero hoy nos ha preocupado. No es tema baladí el no saber los datos de Cataluña.
Estos dos últimos días, está teniendo que validar la información, que llega con cifras que requieren alguna matización porque tienen alguna incongruencia. Está teniendo problemas con la validación de estos datos.!

